Wildtierforschung – Sind Tierversuche für den Artenschutz nötig?
Sie machen nur einen sehr kleinen Prozentsatz aller Tierversuche aus und doch werden sie mitunter herangezogen, um Tierversuche im Allgemeinen zu verteidigen: Tierversuche für den Artenschutz (1,2). Während die allermeisten Tierversuche unter strengstem Verschluss gehalten werden und an authentische Bilder nur durch versteckt gemachte Aufnahmen zu gelangen ist, wird mit Tierversuchen im Artenschutz geradezu offen umgegangen. Kaum eine Tierdokumentation, in der man nicht sieht, wie Wildtiere gefangen werden, um sie zu vermessen, zu markieren oder zu besendern. Ihnen werden Blut- oder Gewebeproben genommen, sie bekommen Ringe an die Beine, Clips an die Flügel, Halsbänder umgehängt oder Rucksäcke aufgeklebt. Die Manipulationen wirken auf den Betrachter vermeintlich harmlos und schließlich kommt die Forschung dem Artenschutz, also den Tieren zugute.
Dieser Beitrag soll zeigen, dass solche Tierversuche - und das sind diese Eingriffe von Rechts wegen - keineswegs unumgänglich für den Artenschutz sind und, dass sie die betroffenen Individuen oft massiv beeinträchtigen. Zudem gibt es zahlreiche innovative Möglichkeiten, die Tieren keinen Schaden zufügen und zu sinnvollen Ergebnissen führen.

Öffentlich sichtbarer Tierversuch: Graugans mit riesiger Halsmanschette in einem Park in Braunschweig. ©ÄgT
Die Wichtigkeit des Artenschutzes
Das Artensterben, auch als Biodiversitätskrise bekannt, beschreibt den rasanten Verlust von Tier- und Pflanzenarten auf der Erde. In den letzten Jahrzehnten hat sich das Artensterben dramatisch beschleunigt. Es wird geschätzt, dass das Aussterben heute bis zu 1.000-mal schneller verläuft als der natürliche Durchschnitt (3). Die Hauptursachen dafür sind menschliche Aktivitäten wie Lebensraumzerstörung, Umweltverschmutzung, Klimawandel und die übermäßige Nutzung der natürlichen Ressourcen.
Die Erforschung der Lebensweise und des Verhaltens von Wildtieren ist essenziell, um die Ökosysteme, in denen diese Tiere leben, zu verstehen und Schutzmaßnahmen zu ergreifen. Ebenso wichtig ist das Studium der Anpassungsfähigkeit von Tieren an neue oder veränderte Lebensräume, sei es aufgrund von Klimawandel oder menschlicher Eingriffe, um entsprechende Maßnahmen zu ihrem Schutz ergreifen zu können.
Artenschutz hat das Ziel, die Vielfalt der Tier- und Pflanzenarten auf unserem Planeten zu bewahren. Diese Biodiversität ist entscheidend für das Gleichgewicht und die Stabilität unserer Ökosysteme. Artenschutz ist damit nicht nur bedeutsam für die Natur, sondern auch für uns Menschen.
Anzahl der Tierversuche im Bereich der Wildtierforschung / des Artenschutzes
In Deutschland schwankt die Zahl der Tiere, die in diesem Bereich registriert werden von Jahr zu Jahr erheblich. Insgesamt ist festzuhalten, dass es sich prozentual gesehen, nur um einen kleinen Teil aller Tierversuche handelt. Allerdings umfasst die Statistik nur Wirbeltiere und Kopffüßer. Insekten, Krebstiere, Würmer und andere Wirbellose werden nicht erfasst.
|
2018 |
2019 |
2020 |
2021 |
2022 |
2023 |
|
|
Mäuse |
6.351 |
2.444 |
1.744 |
9 |
8 |
6 |
|
Hühner |
0 |
0 |
150 |
629 |
1.878 |
0 |
|
Andere Vögel |
108 |
232 |
495 |
345 |
645 |
769 |
|
Reptilien |
0 |
0 |
66 |
44 |
0 |
0 |
|
Frösche |
0 |
0 |
0 |
990 |
0 |
0 |
|
Andere Amphibien |
651 |
0 |
0 |
0 |
0 |
0 |
|
Lachse, Forellen u.a. |
6.881 |
0 |
0 |
14.320 |
1.552 |
5.398 |
|
Andere Fische |
152.212 |
20.865 |
10.109 |
5.646 |
9.656 |
|
|
Andere Tiere |
97 |
46 |
260 |
131 |
255 |
507 |
|
Gesamt |
14.088 |
154.934 |
23.580 |
26.577 |
9.984 |
16.336 |
|
Prozent zur Gesamtzahl |
0,66% |
7,03% |
1,2% |
1,4% |
0,58% |
1,1% |
Tabelle 1: Anzahl der in Deutschland in Tierversuchen für den Zweck „Erhaltung der Art“ verwendeten Tiere und Prozent zur Gesamtzahl (4).
Abgesehen von einer besonders hohen Verwendung von Fischen im Jahr 2019 wurden in den letzten 5 Jahren zwischen 10.000 und 26.000 Tieren für Artenschutzzwecke verwendet. In der EU und Norwegen waren es im Jahr 2022 knapp eine halbe Million Tiere, was 5,85% der Gesamtzahl entspricht (5).
Fang von Wildtieren
Üblicherweise ist der Fang die Voraussetzung für die nachfolgende Erfassung von Daten. Die Bestimmung von Größe und Gewicht, die Entnahme von Blut- und Gewebeproben sowie das Anbringen von Kennzeichnungen und Sendern sind nur möglich, wenn das Tier zuvor gefangen wird. Dieses geschieht bei Vögeln, Fledermäusen und Fischen mit verschiedenen Netzen und Reusen. Andere Tiere werden in Lebendfallen oder mit Schlingen gefangen. Fische werden mitunter auch geangelt. Bei größeren Tieren kommen oft – schon aus Sicherheitsgründen für die beteiligten Menschen – aus der Distanz abgeschossene Betäubungsspritzen zum Einsatz.

Vögel leiden beim Fang Angst und Panik. ©sevaljevic AdobeStock_233278426
Im Gegensatz zu Haustieren sind freilebende Wildtiere nicht an die Nähe des Menschen und Bewegungseinschränkungen gewöhnt. Zahlreiche Studien belegen, dass das Einfangen bei Wildtieren zu erheblichen körperlichen und psychischen Belastungen führen kann – unabhängig davon, ob mit oder ohne Betäubung gearbeitet wird. Diese Schäden reichen von Verletzungen über langfristige Gesundheitsprobleme und Verhaltensänderungen bis hin zum Tod (6-11).
Beispielsweise zeigten Grizzlybären (Ursus arctos) und Amerikanische Schwarzbären (Ursus americanus), die mittels vom Helikopter abgeschossenen Betäubungspfeilen, Tonnenfalle oder Fußschlinge gefangen wurden, nach dem Fang ein verringertes Bewegungsverhalten, das sich erst nach 3 – 6 Wochen wieder normalisierte. Bären, die zweimal gefangen wurden, zeigten in der Folge einen schlechteren körperlichen Zustand als Bären, die nur einmal gefangen wurden (6).
Die Fanghäufigkeit reicht von einmalig für Studien zur Verbreitung einer Art bis hin zu wiederholten Fängen über Tage, Wochen, Monate oder Jahre, etwa zur Messung des Energieverbrauchs oder die spätere Bergung von Sendern. Dass die Fanghäufigkeit einen großen Einfluss auf die Tiere hat, zeigt auch ein anderes Beispiel. Bei wildlebenden Rentieren (Rangifer tarandus platyrhynchus) wurde bei einmaligem Fang eine kurzfristige Erhöhung des Stresshormons Kortisol im Blut festgestellt. Mehrfaches Einfangen mit dem Netz vom Motorschlitten aus (4 Mal in 6 Wochen), führte jedoch dazu, dass weibliche Tiere im folgenden Sommer weniger oft Nachwuchs hatten (7).
Bei einigen der Bären, die mit der Fußschlinge gefangen wurden (s.o.), kam es zu schwerwiegenden körperlichen Schäden – sie entwickelten eine sogenannte Capture Myopathy. Diese durch den Fang-Stress hervorgerufene Muskelkrankheit, wurde erstmals 1964 bei Hunter-Antilopen (Beatragus hunteri) beschrieben und ist seither ein weltweites Problem bei allen Fang- und Umsiedlungsmaßnahmen von wildlebenden Tieren (8).
Innerhalb von Stunden oder wenigen Tagen kommt es zu einem Schock-Syndrom. Die Tiere zeigen einen schwankenden Gang, Apathie, Zittern, Lahmheiten bis hin zu Lähmungen, der Tod tritt oft durch Nierenversagen ein. Betroffen sind vor allem verschiedene Arten von Säugetieren einschließlich mariner Säugetiere wie Wale und Delfine sowie Vögel. Fische, Amphibien und Reptilien sind in Einzelfällen betroffen. Es wurde auch beobachtet, dass Tiere den ersten Fang noch gut überstehen und beim zweiten Mal eine Capture Myopathy entwickeln und sterben (8).
Auslöser scheinen nicht nur der Stress durch die Immobilisierung zu sein, sondern auch Geräusche von Autos oder Hubschraubern, die Nähe des Menschen und Manipulationen wie Messungen und Anbringen von Sendern. Mit Maßnahmen wie Beruhigungsmittel, Ruhe und Kühlung wird versucht, die Gefahr einer Capture Myopathy zu minimieren und doch kommt sie immer wieder vor. Beispiele gibt es in der Literatur unzählige. So wurden in Spanien 4 Zwergtrappen (Tetrax tetrax) mit Fußschlingen gefangen, um ihnen Rucksäcke mit Sendern umzuschnallen. Ein Vogel starb nach einem Tag, weil er sich mit einem Fuß in den Rucksackgurten verfangen hatte, die anderen drei hatten Schwierigkeiten, zu laufen und zu fliegen und starben innerhalb von 5-8 Tagen an Capture Myopathy (9).
Die Nähe zum Menschen und das Angefasst werden wirken sich sogar auf Schmetterlinge aus. So zeigten Raupen, Puppen und ausgewachsene Stadien des Monarchfalters nach 3-minütigen vorsichtigem Anfassen erhöhte Herzfrequenzen (10).
Das Stresserlebnis durch Einfangen und Freilassen kann bei Wildtieren auch zu dramatischen Spätfolgen führen. So gibt es zahlreiche Berichte, denen zufolge Tiere sich weniger gegen Raubtiere wehren konnten, verhungerten, weil sie weniger aßen, sich weniger fortpflanzten oder durch eine verminderte körpereigene Abwehr an Infektionskrankheiten starben (11).
Häufige invasive Forschungsmethoden bei Wildtieren
1. Proben von Blut, Gewebe und Mageninhalt
Blut- und Gewebeproben werden von Wildtieren genommen, um ihren genetischen Status und verschiedene Messgrößen wie Blutzucker, Hormonspiegel oder Gehalt giftiger Substanzen wie Pestizide oder Schwermetalle zu bestimmen. Bei größeren Tieren kann eine Blutentnahme durch Punktion einer Vene an den Beinen, Flügeln, am Hals oder Schwanz erfolgen. Die Blutentnahme bei kleinen Tieren ist jedoch schwierig und so werden Verstümmelungen in Kauf genommen. Bei Schildkröten und kleinen Vögeln wie Kolibris können Zehennägeln abgeschnitten werden (12), um an einen Tropfen Blut zu gelangen. Wenn gleichzeitig eine Markierung erfolgen soll, werden etwa bei Fröschen und Echsen auch ganze Zehen (13) oder bei Fischen ein oder mehrere Flossen abgeschnitten (14).
Um die Nahrungszusammensetzung von Tieren zu studieren, werden diese entweder getötet oder sie werden gefangen und ihnen wird der Magen ausgespült. Beispielsweise wird unbetäubten Fröschen ein Schlauch durch Mund und Speiseröhre in den Magen gesteckt und Wasser wird mit einer Spritze hineingepumpt. Das aus dem Mund austretende Wasser mit Mageninhalt wird aufgefangen. Dies wird wiederholt, bis kein Mageninhalt mehr ausgespült wird (15).
2. Markierungen
Tiere werden auf verschiedene Weise markiert, um die einzelnen Individuen sowohl bei der Beobachtung als auch beim wiederholten Fang unterscheiden zu können. Dabei kommen einerseits Methoden zum Einsatz, die weniger traumatisch sind, wie der Fellschnitt (individuelle Muster werden ins Fell geschnitten) oder Färbung von Fell oder Körperteilen (16). Üblich sind aber auch zahlreiche invasive Markierungsmethoden, die mit Verletzungen und Verstümmelungen der Tiere einhergehen (16,17). In jedem Fall ist das traumatische Erlebnis des Fangs Voraussetzung für die nachfolgende Markierung.
2.1. Verstümmelungen
Das Abschneiden von Zehen („toe clipping“) in unterschiedlicher Position und Anzahl zur Kennzeichnung ist bei „Labor“mäusen im Alter von unter 7 Tagen eine Standardmethode. Bei wildlebenden Mäusen ist diese Methode eher die Ausnahme, kommt aber dennoch vor (17). Dabei kommt es bei manchen Mäusearten zu einer geringen Wiederfangrate (17), was darauf hindeutet, dass die Tiere den Fang mit dem Schmerz der Verstümmelung verbinden. Hingegen ist das Toe clipping bei Amphibien und Echsen sowie das Fin clipping, also das Abschneiden von Flossen bei Fischen, eine übliche Markierungsmethode (14).
2.2. Brandzeichen
Die Kennzeichnung von Rindern und Pferden mit einem glühenden Brenneisen hat eine jahrhundertelange Tradition. Dabei werden Verbrennungen dritten Grades zugefügt, um durch die Narbenbildung eine dauerhafte Kennzeichnung zu gewährleisten. Dass diese Prozedur mit enormen Schmerzen verbunden ist – auch über lange Zeiträume - ist vielfach belegt. So zeigten Fohlen oft wochenlange Schmerzsymptome und waren in ihrem Verhalten beeinträchtigt (18). In der Wildtierforschung wird der Heißbrand bei verschiedenen Robbenarten eingesetzt. Dabei wurden bei Seelöwen (Eumetopias jubatus) Verhaltensänderungen in den ersten 3 Tagen nach dem Branding beobachtet (19). Bei Seehundheulern (Phoca vitulina) war die Wunde nach 9-10 Wochen noch nicht verheilt und bei Seeelefanten (Mirounga leonina) dauerte die Heilung bis zu einem Jahr (19).
2.3. Marken
Eine häufige Kennzeichnungsmethode ist das Anbringen von Marken aus Plastik oder Metall, die mit einer individuellen Nummer versehen werden. Typische Körperteile, an denen die Marken angebracht werden, sind Ohren, Flügel und Flossen. Voraussetzung sind Einfangen und Fixierung der Tiere. Beim Anbringen der Marke wird häufig ein Stück Gewebe ausgestanzt, was mit entsprechenden Schmerzen verbunden ist. Die anschließenden Beeinträchtigungen reichen von Verletzungen der markierten Körperteile, verändertem Verhalten, reduzierter Nahrungsaufnahme bis hin zu erhöhter Todesrate (20-25).
So flogen Geier (Gyps coprotheres), die mit Flügelmarken ausgestattet waren, langsamer, seltener und legten kürzere Strecken zurück als an den Beinen beringte Tiere (20). An den Flügeln markierte Prachtfregattvögel (Fregata magnificens) zeigten einen schlechteren Bruterfolg (21). Eine Untersuchung der Beutereste von Wanderfalken (Falco peregrinus) ergab, dass ungewöhnlich viele Wiesenweihen (Circus pygargus) und Kornweihen (Circus cyaneus) mit Flügelmarken geschlagen worden waren. Das Ergebnis lässt den Schluss zu, dass Marken die Aufmerksamkeit von Raubvögeln auf sich ziehen können, was einer erhöhten Prädationsrate und somit einer höheren Sterblichkeit führen kann (22).
Besonders bei vielen im Wasser lebenden Tieren ist der stromlinienförmige Körperbau überlebenswichtig. Eine vom Menschen angebrachte Marke erhöht den Strömungswiderstand im Wasser und führt zu erschwertem Schwimmen. Dieses wiederum beeinträchtigt die Nahrungsaufnahme und macht das Tier auch zu einer leichteren Beute für Raubtiere. So mussten mit Flügelmarken versehene Magellan-Pinguine (Spheniscus magellanicus) in Jahren mit Nahrungsknappheit für die tägliche Nahrungsaufnahme länger schwimmen als nicht markierte Tiere und verbrauchten dadurch mehr Energie (23). Bei markierten Adélie-Pinguinen (Pygoscelis adeliae) wurden Verletzungen der Flügel und eine verringerte Überlebensrate um 24% beobachtet (24). Anhand einer Computersimulation wurde ermittelt, dass ein auf dem Rücken einer Kegelrobbe (Halichoerus grypus) angebrachtes Gerät den Strömungswiderstand um 12% erhöht, was ein verändertes Schwimmverhalten erwarten lässt (25).

Adélie-Pinguine: Flügelmarken erhöhen den Strömungswiderstand und erschweren das Schwimmen und damit die Nahrungsaufnahme. ©Katie Dugger, USGS
2.4. Besenderung
Tiere werden seit Jahrzehnten besendert, um ihren Aktionsradius und Wanderbewegungen zu verfolgen.
Es gibt drei Ortungs-Techniken:
- sehr hochfrequente Funkortung (VHF)
- Satellitenortung
- Global Positioning System (GPS).
Die Funkortung ist seit den 1960er Jahren Standard in der Wildtierforschung. Dabei sendet ein am Tier angebrachter Sender in regelmäßigen Abständen Signale auf einer vordefinierten Funkfrequenz aus. Mit Antenne und Empfänger kann anhand der Sendefrequenz und der Zeit zwischen zwei Signalen die Position des Tieres bestimmt werden.
Bei der seit den 1980er Jahren eingesetzten Satellitenortung sendet ein am Tier angebrachter Sender Signale zu bestimmten Satelliten, die wiederum auf der Erde empfangen werden können.
Die GPS-Technologie wird in der Wildtierforschung seit den frühen 1990er Jahren eingesetzt. Dabei werden Signale von mindestens 3 Satelliten empfangen, woraus die Position berechnet wird. GPS-Geräte sind zwar klein und leicht, haben aber für die Wildtierforschung den Nachteil, dass die Daten im GPS-Gerät gespeichert werden. Um diese auslesen zu können, muss das Tier ein zweites Mal oder gar wiederholt gefangen werden. GPS- und Satelliten-Technik können auch kombiniert werden, um die Daten kontinuierlich zu erhalten, was aber Größe und Gewicht des Geräts erhöht (26).
Als Stromquelle werden üblicherweise Batterien verwendet oder auch kleine Solarmodule. Es gibt die Möglichkeit, dass der Sender vom Tier abfällt, etwa nach einer vorgegebenen Zeit oder, wenn die Batterie leer ist. So wird dem Tier ein erneutes Einfangen erspart.

Adler mit Sender-Rucksack. ©belizar AdobeStock_79454631
Die Sender werden Tieren äußerlich etwa mit einem Halsband oder Rucksack angebracht oder aufgeklebt. Oder sie werden den Tieren unter die Haut oder in die Bauchhöhle implantiert. Für eine solche Operation müssen die Tiere narkotisiert werden. Die Dauer der Besenderung kann je nach Fragestellung zwischen wenigen Tagen bis vielen Jahren stark variieren.
Die Probleme, die bei der Besenderung auftreten können, sind mannigfaltig. So berichtet eine Studie aus den USA, dass Sperlingsvögel sich mit Körperteilen in den Gurten des Senders verfingen oder sie bleiben in der Vegetation stecken (27). Schreivögeleltern (Sayornis phoebe) warfen ihre Küken aus dem Nest bei dem Versuch, den Sender an ihren Jungen zu entfernen. Bei anderen Sperlingsvögeln (Ammospiza caudacuta) verließen die Eltern ihre Küken oder sie fütterten nur die nicht besenderten Küken (27). Bei Mantelbrüllaffen (Alouatta palliata) wurden schwerwiegende Verletzungen von Haut und Muskeln im Bereich des Halsbands gefunden (28).

Das Gewicht eines Senderhalsband wirkt sich bei Zebras auf das Verhalten beim Grasen aus. ©PACO COMO AdobeStock_134126186
Größe und Gewicht des Senders und der Anbringung spielen eine Rolle. Die Empfehlungen für das Gewicht reichen von 0,7 % bis 9 % mit einem Mittel von unter 5 % des Körpergewichts (29). An Zebras (Equus burchelli antiquorum) in Botswana wurde beobachtet, dass selbst eine kleine Gewichtsänderung große Auswirkungen auf das Verhalten der Tiere hatte. Tiere mit einem schweren GPS-Halsband (1,8 kg) legten beim Grasen um die Hälfte weniger Strecke zurück als Zebras mit einem leichten (1,2 kg) Halsband. Und dass, obwohl beide Halsbänder deutlich unter dem geringsten Richtwert lagen, nämlich bei 0,4 bzw. 0,6% des Körpergewichts (29).
Besonders dramatisch können die Auswirkungen für Tiere sein, denen Sender in die Bauchhöhle eingepflanzt werden. Bei 305 toten oder lebenden Skandinavischen Braunbären, denen VHF-Funksender bis zu 13 Jahre nach dem Einpflanzen herausoperiert wurden, zeigten sich zum Teil schwerwiegende krankhafte Veränderungen wie Entzündungen und Verwachsungen in der Bauchhöhle. Die Batterien waren zum Teil korrodiert oder ausgelaufen. Zwei Bären starben durch einen Kurzschluss der Batterien (30).
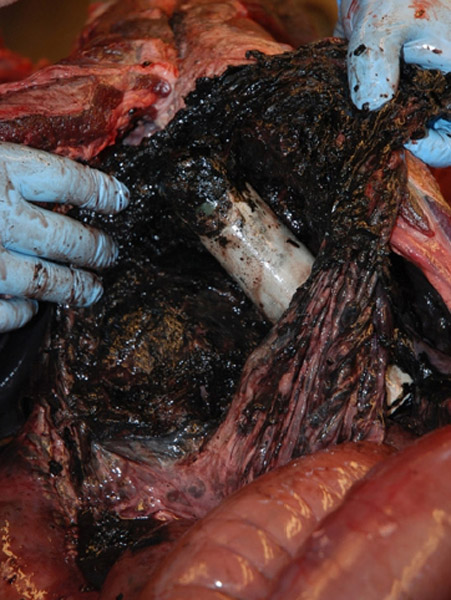
Schwerwiegende pathologische Veränderungen durch einen Sender in der Bauchhöhle eines Bären. Quelle: Arnemo. Frontiers in Veterinary Science 2018; 5: 252
Die starke Immunreaktion zeigte sich auch bei Europäischen Bibern (Castor fiber) und Kanalwelsen (Ictarulus punctatus), denen Geräte in die Bauchhöhle operiert worden waren. Sender sowie Herz- und Temperaturmessgeräte wurden vom Körper abgestoßen und über den Darm oder die Operationswunde nach außen transportiert (31).
Aufgrund ihrer Körperform ist bei Schlangen die chirurgische Implantation von Geräten in die Bauchhöhle Standard. Dabei können jedoch eine Reihe von Problemen auftreten, angefangen vom Narkoserisiko und Wundinfektionen bis hin zu negativen Effekten auf Wachstum und Fortpflanzung (31). Zunehmend werden bei Schlangen auch Geräte extern aufgebracht, z.B. mit Klebstoff oder Klebeband aufgeklebt oder sie werden angenäht. Negative Auswirkungen umfassten verändertes Verhalten und Bewegungsmuster, Haut- und Schuppenverletzungen und sogar Todesfälle (32).
3. Tötung
Zur Bestimmung der Art und für Museumssammlungen wurden in der Vergangenheit üblicherweise die Tiere getötet. In den letzten Jahrzehnten wird zwar verstärkt auf nicht-tödliche Methoden gesetzt, doch gibt es in Fachkreisen immer noch vehemente Verteidiger der Tötung von Tieren für diese Zwecke. So werden immer noch insbesondere Amphibien, Vögel und kleine Nagetiere für die DNA-Analyse getötet (33). Auch Insekten, Spinnen, Skorpione und andere Wirbellose fallen der Bestimmung ihrer Art zum Opfer. Um etwa die Artenvielfalt auf einer Wiese zu bestimmen, werden alle Lebewesen in einem bestimmten Bereich mit einem Kescher eingesammelt und in Alkohol eingelegt.

Sammlungen mit unzähligen, in Alkohol eingelegten Tieren sind Standard an vielen Universitäten. © ÄgT
Rechtliche Vorgaben
„Forschung im Hinblick auf die Erhaltung der Arten“ ist im Tierschutzgesetz als einer der zulässigen Tierversuchs-Zwecke aufgeführt. Tierversuche an Wirbeltieren und Kopffüßern bedürfen einer Genehmigung durch die zuständige Behörde, meist das Regierungspräsidium (34). Tierversuche im Wildtierforschungsbereich werden also genauso geregelt wie andere Tierversuche. Allerdings bedarf es noch einer Ausnahmegenehmigung durch die zuständige Behörde, wenn Tiere „aus der Natur entnommen“ werden (35). Wirbellose Tiere außer Kopffüßer fallen allerdings nicht unter diese rechtlichen Vorgaben, d.h., dass sie verwendet, gequält und getötet werden können - ohne rechtliche Konsequenzen.
Tierversuchsfreie Wildtierforschung
Auf der Website „3R’s Principles in Wildlife Research” von Marina A. Zemanova wird eine Fülle tierversuchsfreier Forschungsmethoden, sortiert nach Forschungsziel und Tierklassen, aufgeführt (36). Forscher können sich in zahlreiche Studien und Anleitungs-Videos informieren.
Leider beschränkt sich die Autorin auf das 3R-Prinzip, das neben dem Ersatz (Replace) auch die Reduktion (Reduce) und Verfeinerung/Verbesserung (Refine) von Tierversuchen beinhaltet. Das in den 1950er Jahren entwickelte Konzept stellt den Tierversuch als Methode nicht in Frage und will lediglich eine Modifikation des bestehenden Systems erreichen. Unser Verein fordert aber die Abschaffung aller Tierversuche aus ethischen und wissenschaftlichen Gründen (37). So findet sich leider auch eine Reihe Studien auf Zemanovas Website, die lediglich ein Refinement darstellen, wenn etwa eine Tupferprobe aus der Mundhöhle von gefangenen Fischen genommen wird (38). Auch das Ausspülen des Magens von Fröschen (15) und das experimentelle Auslösen von Stress bei Kaninchen durch Fuchsgeruch, um den Kortisolspiegel in Kotproben zu messen (39), werden hier als nicht-invasive Methode gelistet. Dennoch kann diese Webseite als überaus wichtige Quelle für tierversuchsfreie Wildtierforschung dienen.
1. Kotproben
Kotproben bergen eine Menge Informationen. So kann über die DNA die Tierart bestimmt werden (40), zudem können physiologische Messgrößen wie Sexual- und Stresshormone (41), Nahrungsbestandteile (42), aufgenommene Schadstoffe wie Schwermetalle, Gifte (43) oder Mikroplastik (44) sowie das Vorhandensein von Parasiten (45) und Viren (46) untersucht werden.
2. Haar- und andere Proben
Haare können zur Artbestimmung mittels DNA-Analyse (47) verwendet oder auf Schwermetalle wie Blei und Quecksilber (48) geprüft werden. Um Haarproben zu erhalten, kommen Haarfallen zum Einsatz. Dies können Klebestreifen in der Nähe der Behausung von Hamstern (49) oder Otter (50) sein, mit Stacheldraht ausgestattete Strommasten (51), an denen sich Bären scheuern, oder für die Gebietsmarkierung bei Luchsen beliebte Bäume (47). Auch gemauserte Haare von Seelöwen (48), Haare, die sich in einer Wildtierunterführung finden (52) oder die Haare von Opfern des Straßenverkehrs (53) können analysiert werden.
Ebenso können in gemauserten Federn von Vögeln DNA (54) und Schwermetalle (55) aufgespürt werden.
Die DNA-Analyse ist heute so weit fortgeschritten, dass das genetische Profil nicht nur aus Kot, Haaren und Federn bestimmt werden kann, sondern auch aus Urin (56), Eierschalen (57), abgeworfenen Geweihen (58), gehäuteter Haut, etwa von Eidechsen (59), aufgesammelten Hautfetzen von Walen (60), und Plazentas von Robben (61). Sogar Spinnennetzen (62) und Schneckenschleim (63) enthalten genügend DNA-Spuren für eine Artbestimmung. Bei Tieren, die sich nur sehr langsam oder gar nicht fortbewegen, wie Muscheln, können Tupferproben zum Einsatz kommen (64). Mit einer Zahnbürste können Hautpartikel bei Mantarochen zur DNA-Bestimmung (65) und mit einem Läusekamm an einer Teleskopstange Hautparasiten bei Seelöwen gesammelt werden (66).
3. Umwelt-Untersuchung
Tiere hinterlassen Spuren in ihrer Umwelt. So kann der genetische Code nicht nur von Wasserlebewesen wie Fischen (67) und Walen (68) in dem von ihnen bewohnten Element aufgespürt werden, sondern auch von Landlebewesen, die Wasser trinken (69) oder nur temporär darin schwimmen (70).
Regenwürmer hinterlassen DNA-Spuren in der Erde (71), Insekten (72), Kolibris und Nektar trinkende Fledermäuse (73) auf Blumen. Mittels Teleskopstange oder Drohne eingefangener Blas von Walen und Delfinen dient nicht nur zur Bestimmung des genetischen Codes (74), sondern er gibt auch Auskunft über den Gesundheitszustand durch Untersuchung auf Bakterien (75), Schadstoffe, wie Chemikalien (76), Hormone (77) und das sogenannte Mikrobiom, also Mikoorganismen, die ein Lebewesen besiedeln (78).

Fledermäuse hinterlassen DNA-Spuren, an den Blüten, die sie besuchen. ©FotoRequest_AdobeStock_598449622
Ein wahrer Fundus ist auch Speichel an übriggelassener Nahrung. Dies können von Vögeln angepickte Früchte sein (79), von Bonobos angekaute Blätter (80), von Bären zurückgelassene Lachsreste (81) oder auch von Schimpansen hergestellte Werkzeuge zum Termitenfischen (82).
Spuren des genetischen Profils finden sich selbst in der Luft, etwa an Schlafplätzen von Fledermäusen (83), in Fußabdrücken im Schnee (84) und in zur Gebietsmarkierung gesetzten Duftmarken (85).
4. Photo ID / Gesichtserkennung / KI
Anstatt Tiere zu markieren oder zu besendern, können moderne, computergestützte Erkennungsmethoden zum Einsatz kommen, die sogenannte Photo-ID, um einzelne Individuen zu identifizieren. Selbst bei Tieren, die auf den ersten Blick gleich aussehen oder von denen aufgrund ihrer Lebensweise nicht viel zu sehen ist, können so individuell zugeordnet werden. Wale können anhand ihrer Fluke oder Rückenfinne erkannt werden (86), Krokodile am Muster ihrer Schwanzschuppen (87), Seekühe an ihrem individuellen Narbenmuster (88) oder Eisbären anhand ihrer Tasthaaranordnung (89). Bei vielen Tieren sind auch Fellfarbe und -muster individuell. Die dafür benötigten Fotos werden etwa durch Fotofallen, Drohnen oder unbemannte Luftfahrzeuge beschafft, ohne die Tiere zu stören.

Wale können anhand ihrer individuellen Form der Fluke identifiziert werden. © ÄgT
Fotos können zudem Auskunft geben über die Nahrungszusammensetzung (90), Parasitenbefall (91) und biometrische Körpermaße (92).
Die Photo-ID-Technik kann auch bei Fuß-, Huf- oder Klauenabdrücken zum Einsatz kommen (93), um Bewegungsmuster einzelner Tiere nachzuvollziehen. Bären (94) und Affen (95) können mittels Gesichtserkennungssoftware zugeordnet werden. Dabei kommt auch Deep Learning zum Einsatz, eine Methode des maschinellen Lernens. Mittels Deep Learning können selbst fliegende Insekten anhand ihrer Flugmuster erkannt werden (96).
Bei Korallenrifffischen wurde durch künstliche Intelligenz (KI) gestütztes hochauflösendes 3D-Tracking eingesetzt, um detaillierte Einblicke in Bewegungsmuster und Energieaufwand der Tiere zu bekommen (97).
Moderne Bildmessungs-Methoden (sog. Photogrammetrie) und 3D-Scanning mit hochauflösenden Kameras können helfen, die Anatomie von Tieren zu erforschen (98). Zur Tierartbestimmung können auch die Gesänge, Laute und Geräusche, die Tiere von sich geben, dienen, etwa das Zirpen der Grillen (99), Fluggeräusche von Bienen und Hummeln (100) oder Ultraschalllaute von Fledermäusen (101).
„Es war ein Fehler, sie mit Instrumenten zu bestücken“
Der Dokumentarfilm „Patrick and the Whale“ zeigt, wie Erkenntnisse über das Verhalten von Tieren mit Geduld und Respekt erlangt werden können, ohne den Tieren zu schaden und er macht aber auch deutlich, wie man es nicht machen sollte.
Der Film erzählt die Geschichte einer außergewöhnlichen Beziehung zwischen Pottwalen und dem amerikanischen Unterwasserfilmer Patrick Dykstra. Mehr als ein Jahrzehnt schwamm und tauchte Dykstra mit Pottwalen, und dokumentierte ihr faszinierendes Verhalten in atemberaubenden Aufnahmen. Über lange Zeiträume hatten zwei Pottwaldamen ein Vertrauensverhältnis zu ihm aufgebaut und ließen ihn teilhaben an ihrer für uns verborgenen Welt. Dykstra wollte dies ausnutzen und die Meeresriesen mit einer Kamera ausstatten. Bei Pottwaldame Dolores ging es gut, sie tolerierte die mit Saugnäpfen angeheftete Kamera, die geplant nach acht Stunden wieder abfiel. Doch Can Opener zeigte beim Versuch, die Kamera anzubringen, deutliche Abwehrreaktionen und trug Patrick diese nicht auf Gegenseitigkeit beruhende Annäherung später nach, indem sie sich ihm nur noch auf einige Meter Abstand näherte. Patrick Dykstra resümiert: „Es war ein Fehler, sie mit Instrumenten zu bestücken und sie wie ein wissenschaftliches Experiment zu behandeln.“ (102)
Patrick and the Whale – eine außergewöhnliche Freundschaft, 72 min, in der ARTE-Mediathek
Heiligt der Zweck die Mittel?
Bei der Wildtierforschung steht der Schutz der Arten und der Biodiversität im Vordergrund. Das Wohl des Einzeltieres rückt dabei regelmäßig in den Hintergrund. Nur so ist es zu erklären, dass seit Jahrzehnten Tiere durch Fang und diverse Manipulationen absichtlich oft schwerstem Leiden ausgesetzt werden. Der Tod der Tiere wird entweder eingeplant oder zumindest billigend in Kauf genommen. Ein Umdenken scheint kaum voranzuschreiten. So ergab eine Umfrage unter Ökologieforschern, dass mehr als ein Viertel von ihnen Tiere zu Untersuchungszwecken tötet, weitere 18 % nutzen ausschließlich invasive Methoden, die bei den Tieren zu Schäden führen können, rund ein Drittel setzt sowohl invasive als auch nicht invasive Techniken ein und lediglich 22 % gaben an, nur nicht-invasive Methoden zu nutzen. Als Hürden für den Einsatz nicht-invasiver Untersuchungen wurden am häufigsten finanzielle Beschränkungen und mangelndes Bewusstsein genannt (103).
Neben dieser erschreckenden offensichtlichen Gleichgültigkeit gegenüber dem Leid des einzelnen Tieres, muss auch die wissenschaftliche Relevanz der erhaltenen Daten hinterfragt werden. Wenn etwa bei einem 320 kg schweren Zebra ein Unterschied von 600 g beim Gewicht des Halsbandes sich massiv auf das Verhalten auswirkt (29), muss gefragt werden, ob nicht selbst das leichteste Halsband und die „schonenste Behandlung“ eine Verhaltensveränderung bewirkt und so das eigentliche Ziel des Versuchs verfehlt wird.
Die Forderung nach einem Verbot aller Tierversuche umfasst zu Recht auch die Wildtierforschung. Sie setzt Tieren Leid und Tod aus, obwohl auch in diesem Bereich moderne tierversuchsfreie Forschungsmethoden in großer Anzahl zur Verfügung stehen. Tierversuche in der Wildtierforschung haben keine Berechtigung und müssen – genau wie alle anderen Tierversuche – abgeschafft werden.
02.06.2025
Dr. med. vet. Corina Gericke
Weitere Infos
The 3Rs principles in wildlife research https://3RsWildlife.info
Quellen
- Tierversuche für den Artenschutz, Tierversuche verstehen. 15.01.2024 [abgerufen am 31.05.2025]
- Richter S.H. et al. Animal research revised – the case of behavioural studies. Trends in Ecology & Evolution 2024; org/10.1016/j.tree.2024.11.014
- Pimm S.L. et al. The biodiversity of species and their rates of extinction, distribution, and protection. Science 2014; 344(6187): 1246752. DOI: 10.1126/science.1246752
- Bundesinstitut für Risikoforschung (BfR): Verwendung von Versuchstieren im Jahr 2022
- ALURES – EU statistics database [abgerufen am 31.05.2025]
- Cattet M. et al. An evaluation of long-term capture effects in ursids: implications for wildlife welfare and research. Journal of Mammalogy 2008; 89(4):973-990
- Trondrud L.M. et al. Stress responses to repeated captures in a wild ungulate. Nature.com. Scientific reports 2022; 12:16289
- Breed D. et al. Conserving wildlife in a changing world: Understanding capture myopathy—a malignant outcome of stress during capture and translocation. Conservation Physiology 2019; 7: 10.1093/conphys/coz027
- Marco I. et al. Capture myopathy in little bustards after trapping and marking. J Wildl Dis 2006; 42(4):889-9
- Davis A.K. et al. Evaluating cardiac reactions of monarch butterflies to human handling across three life stages. The Journal of Lepidopterists’ Society 2020; 74: 43-50
- Dickens M.J. et al Stress: An inevitable component of animal translocation. Biological Conservation 143 (2010) 1329–1341
- Johnson J.D. Nail trimming for blood collection from desert tortoises, Gopherus agazzizii: Panel Summary. Journal of Herpetological Medicine and Surgery 2006; 6(2):61-62
- Grafe T.U. et al. Putting toe clipping into perspective: a viable method for marking anurans. Journal of Herpetology 2011; 45(1):28-35
- Eriksen T.B. Should fin clipping be used as a method for identification of fish? Norwegian School of Veterinary Science 2011
- Solé M. et al. Stomach-flushing for diet analysis in anurans: An improved protocol evaluated in a case study in Araucaria forests, southern Brazil. Studies on Neotropical Fauna and Environment 2005; 40(1): 23-28
- Bundesamt für Umwelt, Schweizerische Eidgenossenschaft: Fang, Markierung und Beprobung von freilebenden Wildtieren. 2018
- Deutsch M. Methoden zur Markierung von Kleinsäugern im Freiland – eine Übersicht. Beiträge zur Jagd- und Wildforschung 2015; 40: 275-287
- Bohnet W. Stellungnahme der Tierärztlichen Vereinigung für Tierschutz (TVT) zur Kennzeichnung von Pferden (Equiden) mittels Heißbrand und/oder Transponder. TVT, 20.08.2010
- Walker K. et al. Behavioural responses of juvenile Steller sea lions to hot-iron branding. Applied Animal Behaviour Science 2010; 122(1):58-62
- Curk T. et al. Wing tags severely impair movement in African Cape Vultures. Curk et al. Anim Biotelemetry 2021; 9:11
- Trefry S.A. Wing marker woes: a case study and meta-analysis of the impact of wing and patagial tags. Journal of Ornithology 2013; 154: 1-11
- Zuberogoitia I. et al. Standing out from the crowd: are patagial wing tags a potential predator attraction for harriers (Circus spp.)? Journal of Ornithology 2012; 153: 985–989
- Wilson R.P. Pushed to the limit: food abundance determines tag-induced harm in penguins. Animal Welfare 2015; 24(1): 37-44
- Jackson S. et al. The potential costs of flipper-bands to penguins. Functional Ecology 2002; 16: 141–148
- Hazekamp A.A.H. et al. Flow simulation along a seal: the impact of an external device. Eur J Wildl Res (2010) 56:131–140
- Mech L.D. and Barber S.M. A Critique of wildlife radio-tracking and its use in the U.S. national Parks. 6.2.2002
- Hill J.M. and Elphick C.S. Are grassland passerines especially susceptible to negative transmitter impacts? Wildlife Society Bulletin 2011; 35(4): 362-367
- Hopkins M.E. et al. Adverse Effects of Ball-Chain Radio-Collars on Female Mantled Howlers (Alouatta palliata) in Panama. Int J Primatol 2016; 37: 213–224
- Brooks C. et al. Effects of global positioning system collar weight on zebra behavior and location error. Wildlife Management 2010: doi.org/10.2193/2007-061
- Arnemo J.M. et al. Long-term safety of intraperitoneal radio transmitter implants in brown bears (Ursus arctos). Frontiers in Veterinary Science 2018; 5: 252
- Mayer M. et al. Retention and loss of PIT tags and surgically implanted devices in the European beaver. BMC Veterinary research 2022; 18:219
- Christensen T. et al. External transmitter attachment in snakes: a systematic review of methods, efficacy, and impacts. Animal Biotelemetry 2024; 12:14
- Waeber P.O. et al. On specimen killing in the era of conservation crisis - A quantitative case for modernizing taxonomy and biodiversity inventories. PLOS One 2017; 12(9): e0183903
- Tierschutzgesetz in der Fassung der Bekanntmachung vom 18. Mai 2006 (BGBl. I S. 1206, 1313), das zuletzt durch Artikel 2 Absatz 20 des Gesetzes vom 20. Dezember 2022 (BGBl. I S. 2752) geändert worden ist
- Tierschutz-Versuchstierverordnung vom 1. August 2013 (BGBl. I S. 3125, 3126), die zuletzt durch Artikel 1 der Verordnung vom 11. August 2021 (BGBl. I S. 3570) geändert worden ist
- Zemanova M.A. The 3Rs principles in wildlife research [abgerufen am 31.05.2025]
- Ärzte gegen Tierversuche. Positionspapier zum 3R-Konzept – Tierversuche reduzieren, ersetzen oder abschaffen. 10.12.2024 [abgerufen am 31.05.2025]
- Colussi S. et al. Buccal swab: A tissue sampling method for refinement of experimental procedures involving rainbow trout. Journal of Applied Ichthyology 2017; 33: 515-519
- Monclús R. et al. Non-invasive measurement of the physiological stress response of wild rabbits to the odour of a predator. Chemoecology 2006; 16: 25-29
- Manning J.A. et al. Scat as a source of DNA for population monitoring. Ecology and Evolution 2022; 12: e9415
- Yang L.L. et al. Non-invasive determination of fecal steroid hormones relating to conservation practice in giant panda (Ailuropoda melanoleuca). Animal Biology 2011; 61: 335-347
- McInnes J.C. et al. High occurrence of jellyfish predation by black‐browed and Campbell albatross identified by DNA metabarcoding. Molecular Ecology 2017; 26: 4831-4845
- Afonso E. et al. Is the lesser horseshoe bat (Rhinolophus hipposideros) exposed to causes that may have contributed to its decline? A non-invasive approach. Global Ecology and Conservation 2016; 8: 123-137
- Desclos‐Dukes L. et al. Using a non‐invasive technique to identify suspected microplastics in grey seals (Halichoerus grypus) living in the western North Sea. Veterinary Record 2022: e1484
- Napoli E. et al. Survey on parasitic infections in wildcat (Felis silvestris silvestris Schreber, 1777) by scat collection. Parasitology Research 2016; 115: 255-261
- Briscoe A.G. et al. High-throughput sequencing of faeces provides evidence for dispersal of parasites and pathogens by migratory waterbirds. Molecular Ecology Resources 2021; 22: 1303-1318
- Schmidt K. et al. Using scent‐marking stations to collect hair samples to monitor Eurasian lynx populations. Wildlife Society Bulletin 2006; 34: 462-466
- Andrade S. et al. Heavy metals in molted fur of the southern elephant seal Mirounga leonina. Marine Pollution Bulletin 2077; 54: 602-605
- Reiners T.E. et al. An optimized hair trap for non-invasive genetic studies of small cryptic mammals. European Journal of Wildlife Research 2011; 57: 991-995
- Pedroso N.M. et al. Non-invasive hair sampling of neotropical otters. Biota Neotropica 2018; 18: e20180579
- Karamanlidis A.A. et al. Noninvasive genetic studies of brown bears using power poles. European Journal of Wildlife Research 2010; 56: 693-702
- Clevenger A.P. et al. Piloting a non-invasive genetic sampling method for evaluating population-level benefits of wildlife crossing structures. Ecology and Society 2010; 15: 7
- Picone M. et al. Neonicotinoids and pharmaceuticals in hair of the red fox (Vulpes vulpes) from the Cavallino-Treporti peninsula, Italy. Environmental Research 2023; 228:115837
- Segelbacher G. Noninvasive genetic analysis in birds: testing reliability of feather samples. Molecular Ecology Notes 2022; 2: 367-369
- Dauwe T. et al. Variation of heavy metals within and among feathers of birds of prey: effects of molt and external contamination. Environmental Pollution 2003; 124: 429-436
- Hausknecht R. et al. Urine – a source for noninvasive genetic monitoring in wildlife. Molecular Ecology Notes 2007; 7: 208-212
- Shamblin B.M. et al. Loggerhead turtle eggshells as a source of maternal nuclear genomic DNA for population genetic studies. Molecular Ecology Resources 2011; 11: 110-115
- Venegas C. et al. Non-invasive genetic sampling of deer: a method for DNA extraction and genetic analysis from antlers. Gayana 2020; 84: 67-74
- Horreo J.L. et al. Skin sheds as a useful DNA source for lizard conservation. Phyllomedusa: Journal of Herpetology 2015; 14: 73-77
- Neveceralova P. et al. Population changes in a whale breeding ground revealed by citizen science noninvasive genetics. Global Ecology and Conservation 2022; 37: e02141
- Valtonen M. et al. Genetic monitoring of a critically-endangered seal population based on field-collected placentas. Annales Zoologici Fennici 2015; 52: 51-65
- Xu C.C. et al. Spider web DNA: a new spin on noninvasive genetics of predator and prey. Plos One 2015; 10: e0142503
- Kawai K. et al. A non-invasive technique for obtaining DNA from marine intertidal snails. Journal of the Marine Biological Association of the United Kingdom 2004; 84: 773-774
- Henley W.F. et al. Non-invasive method to obtain DNA from freshwater mussels (Bivalvia: Unionidae). Journal of Shellfish Research 2006; 25: 975-977
- Kashiwagi T. et al. Evaluating manta ray mucus as an alternative DNA source for population genetics study: underwater-sampling, dry-storage and PCR success. PeerJ 2015; 3: e1188
- Ebmer D. et al. Antarctophthirus microchir infestation in synanthropic South American sea lion (Otaria flavescens) males diagnosed by a novel non-invasive method. Parasitology Research 2019; 118: 1353-1361
- Yang J. et al. Small changes make big progress: A more efficient eDNA monitoring method for freshwater fish. Environmental DNA 2023; 5: 363-374
- Székely D. et al. Environmental DNA captures the genetic diversity of bowhead whales (Balaena mysticetus) in West Greenland. Environmental DNA 2021; 3: 248-260
- Ushio M. et al. Environmental DNA enables detection of terrestrial mammals from forest pond water. Molecular Ecology Resources 2017; 17: e63-e75
- Reinhardt T. et al. Monitoring a loss: Detection of the semi‐aquatic crocodile lizard (Shinisaurus crocodilurus) in inaccessible habitats via environmental DNA. Aquatic Conservation: Marine and Freshwater Ecosystems 2019; 29: 353-360
- Bienert F. et al. Tracking earthworm communities from soil DNA. Molecular Ecology 2012; 21: 2017-2030
- Thomsen P.F. et al. Environmental DNA metabarcoding of wild flowers reveals diverse communities of terrestrial arthropods. Ecology and Evolution 2019; 9: 1665-1679
- Walker F.M. et al. Endangered nectar-feeding bat detected by environmental DNA on flowers. Animals 2022; 12: 3075
- Raudino H.C. et al. Challenges of collecting blow from small cetaceans. Ecosphere 2019; 10: e02901
- Acevedo‐Whitehouse K. et al. A novel non‐invasive tool for disease surveillance of free‐ranging whales and its relevance to conservation programs. Animal Conservation 2010; 13: 217-225
- Cumeras R. et al. Chemical analysis of whale breath volatiles: a case study for non-invasive field health diagnostics of marine mammals. Metabolites 2014; 4: 790-806
- Hogg C.J. et al. Determination of steroid hormones in whale blow: it is possible. Marine Mammal Science 2009; 25: 605-618
- Apprill A. et al. Extensive core microbiome in drone-captured whale blow supports a framework for health monitoring. mSystems 2017; 2: e00119-17
- Monge O. et al. Environmental DNA from avian residual saliva in fruits and its potential uses in population genetics. Conservation Genetics Resources 2020; 12: 131–139
- Ishizuka S. et al. Bonobos’ saliva remaining on the pith of terrestrial herbaceous vegetation can serve as non-invasive wild genetic resources. Primates 2019; 60: 7-13
- Wheat R.E. et al. Environmental DNA from residual saliva for efficient noninvasive genetic monitoring of brown bears (Ursus arctos). Plos One 2016; 11: e0165259
- Stewart F.A. et al. DNA recovery from wild chimpanzee tools. Plos One 2018; 13: e0189657
- Garrett N.R. et al. Out of thin air: surveying tropical bat roosts through air sampling of eDNA. PeerJ 2023; 11: e14772
- Kinoshita G. et al. Environmental DNA collected from snow tracks is useful for identification of mammalian species. Zoological Science 2019; 36: 198-207
- Malherbe G.P. et al. Genetic clues from olfactory cues: brown hyaena scent marks provide a non-invasive source of DNA for genetic profiling. Conservation Genetics 2009; 10: 759-762
- Franklin T. et al. Photo-identification of individual Southern Hemisphere humpback whales (Megaptera novaeangliae) using all available natural marks: managing the potential for misidentification. Journal of Cetacean Research and Management 2020; 21: 71-83
- Boucher M. et al. A tail of two crocs: coding tail-spot patterns for individual identification of American (Crocodylus acutus) and Morelet’s (Crocodylus moreletii) crocodiles. Mesoamerican Herpetology 2017; 4: 760-772
- Landeo-Yauri S.S. et al. Using small drones to photo-identify Antillean manatees: a novel method for monitoring an endangered marine mammal in the Caribbean Sea. Endangered Species Research 2020; 41: 79-90
- Anderson C.J.R. et al. Can whisker spot patterns be used to identify individual polar bears? Journal of Zoology 2007; 273: 333-339
- Naude V.N. et al. Using web-sourced photography to explore the diet of a declining African raptor, the Martial Eagle (Polemaetus bellicosus). The Condor: Ornithological Applications 2019; 121: duy015
- Barroso P. et al. Camera traps reveal a high prevalence of sarcoptic mange in red foxes from northern Spain. Research in Veterinary Science 2023; 166: 105098
- Ulikowski D. et al. In vivo calibration of juvenile crayfish body length and weight with a photographic-computer method. Fisheries & Aquatic Life 2009; 17: 89-93
- Alibhai S. et al. The challenge of monitoring elusive large carnivores: an accurate and cost-effective tool to identify and sex pumas (Puma concolor) from footprints. Plos One 2017; 12: e0172065
- Clapham M. et al. Automated facial recognition for wildlife that lack unique markings: A deep learning approach for brown bears. Ecology and Evolution 2020; 10: 12883-12892
- Crouse D. et al. LemurFaceID: a face recognition system to facilitate individual identification of lemurs. BMC Zoology 2017; 2: 2
- Kirkeby C. et al. Advances in automatic identification of flying insects using optical sensors and machine learning. Scientific Reports 2021; 11: 1555
- Lilkendey J. et al. Herbivorous fish feeding dynamics and energy expenditure on a coral reef: Insights from stereo-video and AI-driven 3D tracking. Ecology & Evolution 2024; 14: e11070
- Deakos M.H. Paired-laser photogrammetry as a simple and accurate system for measuring the body size of free-ranging manta rays Manta alfredi. Aquatic Biology 2010; 10: 1-10
- Jeliazkov A. et al. Large-scale semi-automated acoustic monitoring allows to detect temporal decline of bush-crickets. Global Ecology and Conservation 2016; 6: 208-218
- Kawakita S. et al. Automated classification of bees and hornet using acoustic analysis of their flight sounds. Apidologie 2019; 50: 71-79
- Mac Aodha O. et al. Bat detective – Deep learning tools for bat acoustic signal detection. Plos Computational Biology 2018; 14: e1005995
- Patrick and the Whale – eine außergewöhnliche Freundschaft. Dokumentarfilm, Österreich 2023
- Zemanova M.A. Making room for the 3R’s principles of responsible animal use in ecology: Potential issues identified through a pilot survey. European Journal of Ecology 2021; 7(2): 18-39
