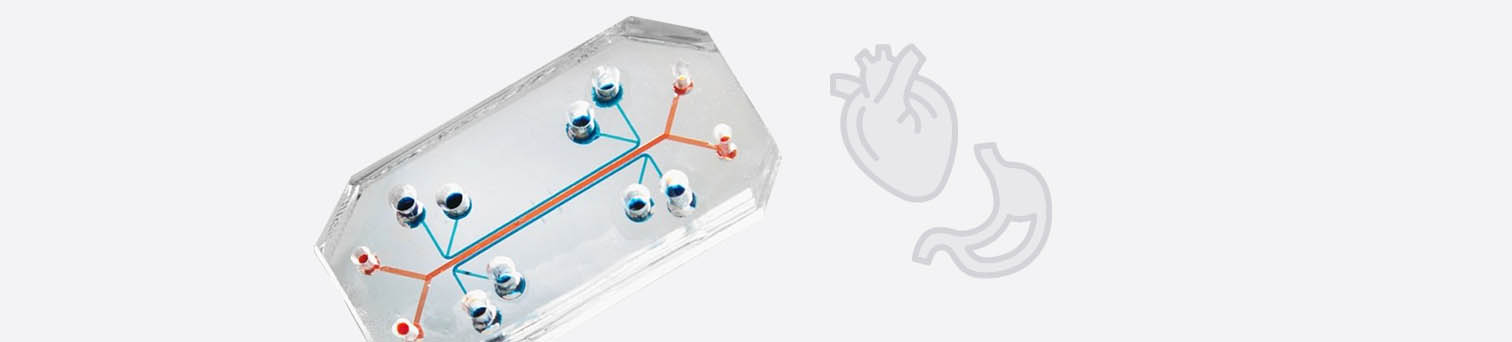
Woran soll man denn sonst testen?
Moderne Forschungsmethoden ohne Tierversuche
I. Einleitung
Immer wieder wird behauptet, Tierversuche seien notwendig, um Sicherheit für den Menschen zu gewährleisten und ohne Tierversuche würde medizinischer Fortschritt zum Stillstand kommen. Zahlreiche wissenschaftliche Publikationen zeigen auf, dass dies nicht stimmt (1–4). Kritik wird bei weitem nicht nur von Tierrechtsorganisationen geübt, sondern auch von zahlreichen renommierten Forschern aus der ganzen Welt, sowie von Institutionen der Europäischen Kommission und internationalen politischen Instanzen. Immer mehr Staaten, darunter die USA (5), die Niederlande (6), Großbritannien (7) und Norwegen (8), entwickeln konkrete strategische Pläne zu einem zumindest teilweisen Ausstieg aus dem Tierversuch. Das Hauptproblem ist, dass Tierversuche keine zuverlässige Vorhersagekraft für menschenrelevante Fragestellungen haben und die Übertragung der Ergebnisse auf den Menschen ein unkalkulierbares Risiko darstellt.
Dahingegen existieren heutzutage zahlreiche tierversuchsfreie In-vitro-Methoden, die zuverlässiger und kostengünstiger sind als Tierversuche und im Gegensatz zum Tierversuch für den Menschen relevante Versuchsergebnisse liefern. Um jedoch einen Paradigmenwechsel herbeizuführen, muss der Tierversuch als „Goldstandard“ in der Forschung abgeschafft und Forschungsgelder müssen umgeschichtet werden. Noch immer werden Tierversuchsprojekte in Deutschland jährlich mit Milliarden unserer Steuergelder gefördert, während in die moderne, tierversuchsfreie Forschung lediglich Millionenbeträge fließen (9).
Dieser Artikel gibt einen Überblick über innovative tierversuchsfreie Forschungsmethoden und erklärt, warum diese dem Tierversuch wissenschaftlich überlegen sind.
NAT Database
Heutzutage gibt es eine solche Fülle an großartigen tierversuchsfreien Forschungsmethoden, dass es schwerfällt, den Überblick zu behalten. Jeden Tag gibt es zahlreiche Meldungen zu neuen innovativen Verfahren, die Forscher auf der ganzen Welt entwickeln. Um eine Übersicht und eine gezielte Suche zu erleichtern, haben wir die NAT-Database entwickelt, eine kostenlose zweisprachige Online-Datenbank (Deutsch und Englisch) zu tierversuchsfreien Forschungsmethoden (www.nat-database.de). NAT steht für Non-Animal Technologies und die Datenbank enthält hunderte Einträge, wobei sie kontinuierlich erweitert wird. Die Einträge enthalten eine kurze Zusammenfassung der Methode inkl. Quellen, sowie Informationen zum verantwortlichen Forscher und dem entsprechenden Forschungsinstitut oder Unternehmen. Die Suchmaske ermöglicht sowohl eine freie Schlagwortsuche als auch Filter-Möglichkeiten nach Fachbereich (z.B. Onkologie oder Toxikologie), Modell (z.B. Multi-Organ-Chips), Land usw.
II. Innovative Forschungsmodelle des 21. Jahrhunderts
Heutige In-vitro-Modelle, die für die biomedizinische Forschung genutzt werden, sind komplexer und physiologischer denn je. Sie reichen von dreidimensionalen Zellkulturen über Organoide bis hin zu Multi-Organ-Chips, auf denen mehrere Organmodelle kombiniert und mit einem simulierten Blut- und Urinkreislauf miteinander verbunden werden. Diese humanen Zellmodelle können aus induzierten pluripotenten Stammzellen (iPSCs) gezüchtet werden, also Zellen, die sich in jeden beliebigen Zelltyp, wie Nerven- oder Hautzelle, verwandeln lassen. Die Zellen können sowohl von gesunden Spendern als auch von Patienten stammen. Vor allem als Krankheitsmodelle und für die Entwicklung von Medikamenten oder die Testung von giftigen Substanzen sind sie hochrelevant. Viele dieser Systeme wurden bereits erfolgreich validiert, insbesondere für den Bereich der gesetzlich vorgeschriebenen Tierversuche wie die Sicherheitsprüfung von Chemikalien. Kontinuierliche Optimierungen, u.a. hinsichtlich der Integration von Blutgefäßen und Immunsystem, führen dazu, dass die humanbasierten In-vitro-Modelle die Problematik der mangelnden Übertragbarkeit von Tierversuchen auf den Menschen überwinden können.
Für die wissenschaftliche Diskussion um die Abschaffung von Tierversuchen spielt die Etablierung dieser Systeme und ebenso die Entwicklung von komplexen Computersimulationen (In-silico-Verfahren) eine entscheidende Rolle. Mit diesen Verfahren stehen nun Forschungsmodelle zur Verfügung, die bereits heute eine bessere Vorhersagekraft für den Menschen haben als Tierversuche, wie Vergleichsstudien zeigen (10–12). In Kombination mit Humanstudien und bildgebenden Verfahren hat die Forschung das ideale Werkzeug, um zuverlässige Forschungsergebnisse zu generieren.
- In vitro (lat: „im Reagenzglas“): Test-Systeme mit schmerzfreier Materie in Form von Zellen, Geweben, Mikroorganismen usw.
- In silico (lat.: „im Silizium“): Computer-basierte Modelle
- In vivo (lat.: „im Lebenden“): Versuche, die im lebenden Organismus stattfinden.
1. Organoide und 3D-Zellkultur
In den vergangenen Jahren hat die humanbasierte In-vitro-Forschung eine spektakuläre Entwicklung hingelegt. Forschern ist es um das Jahr 2010 erstmals gelungen, sogenannte Organoide im Labor zu züchten (13–15). Dabei handelt es sich um dreidimensionale humane Zellkulturen, die das Erscheinungsbild und die Funktion eines menschlichen Organs erstaunlich gut widerspiegeln (16). Bis dato wurden in der biomedizinischen In-vitro-Forschung hauptsächlich zweidimensionale Zellkulturen eingesetzt. Das sind „unsterbliche“ Zelllinien, die eine flache Zellschicht bilden. Solch ein Modell ist von Aufbau und Funktion eines dreidimensionalen Organs weit entfernt. Die modernen 3-dimensionalen Zellkultursysteme wie Organoide haben nicht nur zahlreiche Vorteile gegenüber den alt bekannten Zelllinien, sondern auch gegenüber Tierversuchen. Die humanbasierten In-vitro-Modelle wie Organoide sind für die Testung von Medikamenten und die Erforschung humaner Krankheiten essentiell. Sie haben zudem den einzigartigen Vorteil, dass sie eine personalisierte, also auf den einzelnen Menschen individuell zugeschnittene, Medizin ermöglichen. Eine Eigenschaft, die Tierversuche niemals widerspiegeln können.

Das Auge-auf-dem-Chip besteht aus menschlichen Augenhornhaut- und Bindegewebszellen sowie einem blinzelnden Augenlid. (Bildquelle: BIOLines)
iPSC – die Alleskönnerzellen
Humane Organoide werden basierend auf menschlichen Stammzellen gezüchtet (17). Hierbei werden entweder Stammzellen aus Gewebebiopsien isoliert oder es werden z.B. Haut- oder Haarwurzelzellen eines menschlichen Spenders durch gentechnische Verfahren zu induzierten pluripotenten Stammzellen (iPSC: induced pluripotent stem cell) umprogrammiert. Auch Zahnmark oder Blut können als Quelle für Stammzellen dienen. Großer Vorteil des iPSC-basierten Verfahrens ist, dass die Gewinnung der Spenderzellen für den Menschen unkompliziert und schmerzfrei ist und dass die geschaffenen iPSCs in vitro praktisch jedes beliebige Organoid bilden können.
Mini-Organe – Abbilder menschlicher Organe
Durch Anpassung der Kulturbedingungen, insbesondere der eingesetzten Wachstumsfaktoren, werden dann beispielsweise Darm-, Gehirn-, Leber- oder Nierenorganoide gezüchtet. Die Organoide – oder Mini-Organe - sind komplexe dreidimensionale Gebilde aus verschiedenen Zellarten, die in der Regel einen halben bis einen Millimeter groß sind. Sie lassen sich über mehrere Wochen oder Monate in Zellkulturplatten kultivieren und praktisch unbegrenzt in vitro vermehren. Sowohl iPSCs als auch die Organoide selbst können in gefrorenem Zustand gelagert werden, so dass aktuell riesige Biobanken geschaffen werden, die iPSCs oder Organoide etlicher menschlicher Spender (gesunder und erkrankter) enthalten (18). Auf diese Weise können bei Bedarf Proben aufgetaut und wieder in Kultur genommen werden, um die gewünschten Testungen daran durchzuführen.
Organoide konservieren in vitro die Eigenschaften des Zellspenders, so dass sie ein ideales Krankheitsmodell für die biomedizinische Forschung darstellen, wenn man sie aus Patienten generiert. Zudem können Organoide in vitro gentechnisch so verändert werden, dass gezielt Krankheitsgene entweder korrigiert (19) oder eingebaut (20) werden. Solche Krankheitsmodelle sind wesentlich aussagekräftiger als gentechnisch veränderte „Tiermodelle“.
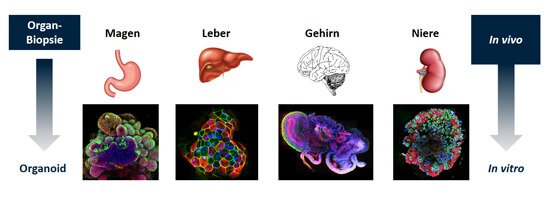
Da alle Organe ihre eigenen Stammzellen besitzen, kann aus jedem Organ im Labor ein Organoid gezüchtet werden. An den unterschiedlichen Farben bei den Fluoreszenz-mikroskopischen Aufnahmen sieht man, dass die Organoide komplexe und vielfältige Strukturen aufweisen, die denen des echten Organs ähneln.
Bildquelle: Ärzte gegen Tierversuche e.V.
Sowohl die molekularen Ursachen menschlicher Erkrankungen, als auch therapeutische Ansätze lassen sich mithilfe dreidimensionaler Zellmodelle wie der Organoide exzellent erforschen (21). Gehirnorganoide („Mini-Hirne“) oder andere komplexe neuronale Zellmodelle wurden bereits aus Patienten gezüchtet, die an Alzheimer (22), Parkinson (23), Schizophrenie (24) und Autismus (25) oder Chorea Huntington (26) leiden. Bei neurologischen Erkrankungen wie Morbus Alzheimer besteht eine besonders dringende Notwendigkeit, neue Modellsysteme zu etablieren, die auf menschlichen Zellen basieren, da die bisherige Forschung an hunderten „Tiermodellen“ bis heute keine zufriedenstellende Behandlung ermöglicht (27–29).
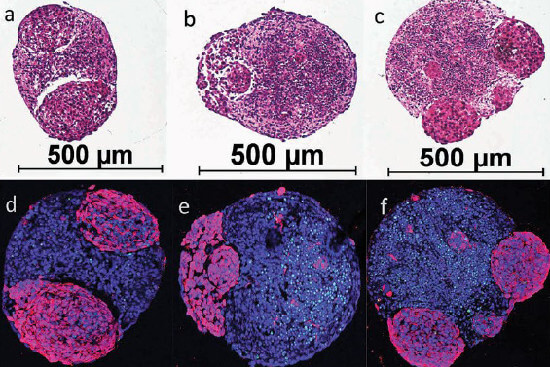
Menschliche Mini-Gehirne, die Gehirntumore entwickeln. Unten (d-f) sieht man das gesunde Gehirngewebe in blau und die Tumore in violett. Der Durchmesser der Mini-Gehirne beträgt ca. 0,5 mm. Bildquelle: Plummer et al - SciRep 2019 (1).
Ideale Krankheitsmodelle
Unzureichende Wirksamkeit und inakzeptable Nebenwirkungen führen häufig dazu, dass Therapien abgebrochen werden müssen oder Medikamente sogar zurückgezogen werden. Als Krankheitsmodell sind dreidimensionale In-vitro-Modelle, die man aus Zellen von Patienten züchtet, ideal geeignet, da sie humanrelevante Ergebnisse liefern. Anhand von Nervenzellen, die aus iPSCs von magersüchtigen Patientinnen kultiviert wurden, konnte ein Gen identifiziert werden, das im Zusammenhang mit Magersucht (Anorexia nervosa) zu stehen scheint (30). Humane Gehirnorganoide werden auch für die Krebsforschung eingesetzt, indem sie mit menschlichen Tumorzellen versetzt werden, so dass sich in ihnen Gehirntumore entwickeln (31). Anhand dieses In-vitro-Modells können dann Wirkstoffe hinsichtlich ihrer Wirksamkeit und Effektivität getestet werden.
Personalisierte Krebstherapie
Da jeder Mensch und auch jeder Tumor anders auf eine bestimmte Behandlung reagiert, ist es ein großer Vorteil, dass iPSC-basierte In-vitro-Modelle eine personalisierte Medizin ermöglichen. Diese ist bereits in der klinischen Anwendung angekommen: In Absprache mit dem behandelnden Onkologen wird eine Tumor-Biopsie des Patienten ins Labor geschickt, aus der Tumor-Organoide („Mikrotumore“) gezüchtet werden. Daran können dann diverse Therapiemöglichkeiten getestet werden und die individuell am besten wirksamen Medikamente werden dem Patienten schließlich verabreicht (32). Die Mikrotumor-Technologie eignet sich auch für die Erforschung neuer Medikamente, deren Wirksamkeit in den Tumororganoiden analysiert werden kann (33,34). Die Entwicklung von Krebsmedikamenten in Tierversuchen birgt die Gefahr, dass die Ergebnisse nicht auf den Menschen übertragbar sind. In Anbetracht der individuell unterschiedlichen Wirksamkeit beim Menschen bzgl. Effektivität und Nebenwirkungen von Krebsmedikamenten hat die personalisierte Krebstherapie ein enorm hohes Potenzial im Gegensatz zur Testung in artfremden Spezies wie Mäusen, in denen menschliche Tumore künstlich herangezüchtet werden (35).
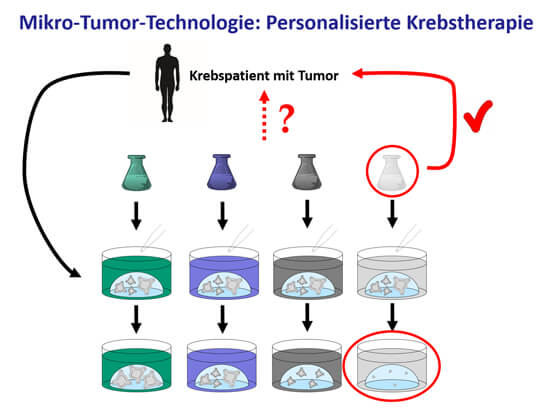
Die Mikrotumor-Technologie ermöglicht eine personalisierte Krebstherapie. Aus einer Tumorbiopsie eines Patienten werden Tumor-Organoide in vitro kultiviert und vermehrt. Anschließend werden diverse Therapiemöglichkeiten daran getestet und dem Patienten letztendlich die Medikation verabreicht, die in vitro die beste Wirkung gezeigt hat.
3D-Biodruck
Komplexe menschliche Zellmodelle können nicht nur aus Stammzellen kultiviert, sondern auch mittels 3D-Biodruck konstruiert werden (36). Hierzu wird ein 3D-Drucker verwendet und spezielle Biotinten, die neben einer Gel-artigen Substanz auch die menschlichen Zellen für das Modell enthalten. Biotinten enthalten allerdings häufig Substanzen tierischen Ursprungs wie fetales Kälberserum. Der Ansatz des Clean Bioprinting verfolgt die Etablierung eines Systems, das komplett frei von tierischen Inhaltsstoffen ist (37). Computergesteuert werden verschiedenste komplexe Zellmodelle gedruckt, die unterschiedliche humane Zelltypen enthalten, die in verschiedenen Anordnungen so zusammengesetzt werden, dass eine Organ-ähnliche Struktur entsteht. So werden z.B. menschliche Herz-, Haut- oder Lungenmodelle gedruckt, um Medikamente zu testen, Krankheiten oder Infektionsprozesse zu erforschen und die Giftigkeit von Substanzen zu testen (38–40).
2. Wie ein „Mini-Mensch“: Multi-Organ-Chips
Ein In-vitro-System, das für die Zukunft der Biomedizin und der Medikamentenentwicklung von höchster Bedeutung ist, ist der sogenannte Multi-Organ-Chip (MOC) (41). Bei MOCs werden mehrere Organoide oder ähnliche menschliche Zellmodelle auf einem Biochip untergebracht, auf dem sie über ein Mikrokanal-System miteinander verbunden sind. Die Mikrokanäle, die die Organe auf dem Chip miteinander verbinden, simulieren den Blutkreislauf und ggf. auch den Urinkreislauf, wenn sich ein Nierenmodell auf dem Chip befindet. Aus dem Mikrokanal-System können Proben entnommen werden, die einer Blutabnahme oder Urinprobe beim Patienten entsprechen. Die Organe auf dem Chip haben einen Stoffwechsel und können über das Mikrokanal-System miteinander interagieren und Stoffe austauschen. Verglichen mit der isolierten Kultivierung der einzelnen Organmodelle, verbessern sich beim MOC die Organ-spezifischen Funktionen teilweise sogar durch die Interaktion mit den anderen Organen. Der MOC wird an ein elektronisches Steuerungselement angeschlossen, so dass man diverse Messgrößen wie die Flussrate, oder die Reihenfolge, in der die Organe angesteuert werden, Computer-basiert regulieren kann.

4-Organ-Chip
In das System können Nährlösungen eingeleitet werden, aber auch Medikamente, Chemikalien oder Giftstoffe sowie Wirkstoff-Kombinationen. Bei der Testung kann eine intravenöse (in die Blutbahn) oder eine orale Gabe (über den Mund) bestimmter Substanzen simuliert werden. Soll ein bestimmtes Medikament beim Patienten oral verabreicht werden, wird es in dem MOC erst in den Darm geleitet, wo es aufgenommen wird, und erreicht dann die weiteren Organe wie Leber und Niere, wo es abgebaut und ausgeschieden wird. Gerade im Bereich der Toxikologie (Giftigkeitstestung) etablieren sich diese Systeme rasant, da sie humanrelevante Daten liefern.
Die Auswirkung der eingeleiteten Substanzen auf die einzelnen Organe kann untersucht werden, indem die Organmodelle vom Chip entnommen und analysiert werden. Auch der Abbau eines Wirkstoffs kann durch Analyse der entnommenen Proben aus dem Mikrokanal-System verfolgt werden (pharmakokinetische Untersuchungen). In den Chip sind Komponenten wie eine Mikropumpe oder pH- und Sauerstoffsensoren integriert, die es ermöglichen, Blutdruck und Puls zu simulieren (42). Je nach wissenschaftlicher Fragestellung werden unterschiedliche und unterschiedlich viele Organe auf dem Chip platziert. So enthält ein MOC zur Erforschung von Diabetes ein Bauchspeicheldrüsen-Modell, sowie insulin-sensitive Organe wie Leber oder Muskel (43), während für die Erforschung von Fettleibigkeit Leber, Fettgewebe und ein Blutgefäß-Modell eingesetzt werden (44).
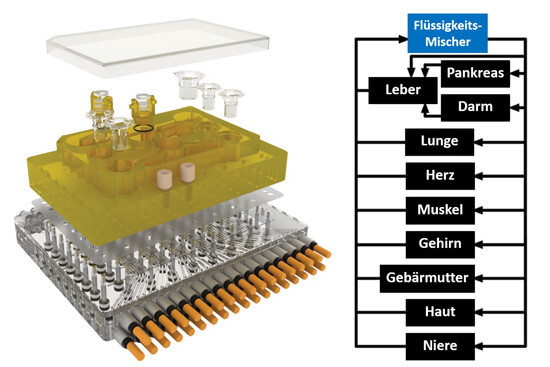
Forscher vom Massachusetts Institute of Technology, USA, entwickelten einen Organ-Chip, auch microphysiological system (MPS) genannt, auf dem 10 menschliche Mini-Organe untergebracht sind: Bauchspeicheldrüse, Leber, Darm, Lunge, Herz, Muskel, Gehirn, Gebärmutter, Haut und Niere (45). Die Mini-Organe interagieren in dem MPS miteinander, haben einen richtigen Stoffwechsel und erfüllen bis zu 4 Wochen lang Funktionen der echten Organe. Der bekannte Entzündungshemmer Diclofenac wurde im MPS getestet, und Verteilung und Abbau spiegeln in den Mini-Organen und im Durchfluss-System die Verstoffwechselung des Medikaments im menschlichen Körper wider.
Das MPS wird momentan für die Hochdurchsatz-Anwendung etabliert, d.h. automatisierte Abläufe, bei denen Tausende Substanzen in kürzester Zeit gemessen werden können. Das ist entscheidend für die Etablierung in der Pharmaindustrie. Auch die verwendeten Zellkultur-Modelle werden kontinuierlich weiterentwickelt, so dass sie den echten menschlichen Organen immer mehr ähneln.
Bildquelle: Holloway PM et al. Stroke 2016 (modifiziert).

MOC im Weltall
Die NASA finanziert ein Forschungsprogramm, bei dem MOCs mit modernen menschlichen Zellkultursystemen zum ISS National Lab, einem Labor auf der ISS-Raumstation, geflogen werden (46). Diese MOCs simulieren beispielsweise ein humanes Immunsystem bestehend aus Immun-, Knochenmarks- und Blutgefäßzellen. Die Chips werden zwei Wochen lang im All getestet und anschließend eingefroren, um sie zu konservieren und nach ihrer Rückkehr zur Erde verschiedenen Analysen zu unterziehen. Man möchte auf diese Weise herausfinden, wie sich der Aufenthalt im Weltall auf den Alterungsprozess des menschlichen Immunsystem auswirkt, um daraus Rückschlüsse auf die körpereigenen Reparaturmechanismen zu ziehen. Des Weiteren wird ein Nieren-Chip zum ISS-Labor geschickt, sowie Knochen- und Knorpel-Chips und ein Chip, der die Blut-Hirn-Schranke abbildet. Für die Entzündungsforschung folgt noch ein Chip, auf dem Lunge und Knochenmark miteinander verbunden sind.
(Symbolbild) Bildquelle: Pixabay/Ärzte gegen Tierversuche e.V.

Fetales Kälberserum
Um Zellen am Leben zu halten und zum Wachsen zu bringen, benötigen sie ein Nährmedium, d.h. eine Flüssigkeit, in der verschiedene Nährstoffe enthalten sind. Standardmäßig wird dafür bisher Blutserum von ungeborenen Kälbern genutzt. Um fetales Kälberserum (FKS) zu gewinnen, wird direkt nach der Schlachtung einer schwangeren Kuh dieser der Fötus aus der Gebärmutter herausgeschnitten. Dem noch lebenden Kalb wird eine dicke Nadel ins schlagende Herz gestoßen, das Blut wird abgesaugt, bis das Tier blutleer ist und stirbt. Diese Prozedur geschieht ohne Betäubung, obwohl davon auszugehen ist, dass Kälberfeten bereits leidensfähig sind (47). Es gibt bereits eine Vielzahl FKS-freier Nährmedien (48). Das humane Blutplättchen-Lysat (hPL) etwa wird aus abgelaufenen Blutspenden gewonnen, die normalerweise weggeworfen werden. Daneben gibt es eine ganze Reihe weiterer FKS-freier Nährmedien, die aus menschlichem Blut oder synthetisch hergestellt werden. Das größte Problem beim Umstieg auf diese ethisch unbedenklichen Nährmedien ist, dass Labore lieber auf Altbewährtes zurückgreifen, denn seit den 60er Jahren gilt das fetale Kälberserum als „Goldstandard“. Und das obwohl FKS wegen seiner variablen Zusammensetzung die Ergebnisse verfälschen kann.
Video „Fortschritt ohne Tierversuche? – Mini-Organe und Multi-Organ-Chips: Wie geht das?“
Mit dem Aufruf des Videos erklären Sie sich einverstanden, dass Ihre Daten an YouTube übermittelt werden und das Sie die Datenschutzerklärung gelesen haben.
3. Computermodelle
Hochrelevant sind auch die so genannten In-silico-Verfahren, also Computer-basierte Methoden, die in den letzten Jahren entwickelt wurden, um die Wirksamkeit und Giftigkeit von Substanzen im menschlichen Organismus vorherzusagen. Die chemischen Eigenschaften neuer Substanzen werden mithilfe solcher Verfahren vorhergesagt und z.B. mit Daten von bereits anerkannten Chemikalien abgeglichen. Solche Computerprogramme haben nachgewiesenermaßen eine bessere Vorhersagekraft im Vergleich zu Tierversuchen (10–12). In-silico-Verfahren wie QSAR- (Quantitative Structure-Activity Relationship) oder PBKD- (Physiologically Based Kinetic and Dynamic) sind von der europäischen Institution ECVAM (European Centre for the Validation of Alternative Methods) und der weltweiten OECD bereits validiert und als Alternative zu Tierversuchen im regulatorischen Bereich akzeptiert (49).
4. Bildgebende Verfahren
Bildgebende Verfahren gibt es schon seit vielen Jahrzehnten und sie werden stetig weiterentwickelt und optimiert. Relevante Erkenntnisse für den Bereich der humanmedizinischen Grundlagenforschung lassen sich an menschlichen Patienten auf diese Weise direkt gewinnen. Hierzu zählen beispielsweise die Computertomografie und andere tomografische Verfahren (50,51). Dabei werden Organe als dreidimensionales Gesamtbild dargestellt. In der Hirnforschung können so einzelne Bereiche des menschlichen Gehirns während bestimmter Hirnleistungen bildlich dargestellt werden. Aktive Hirnzellen lassen sich identifizieren, während sich eine Versuchsperson Bilder oder Wörter einprägt oder andere Aufgaben durchführt. Solche Untersuchungen des menschlichen Gehirns mittels bildgebender Verfahren liefern eine viel bessere Aussagekraft als absurde Verhaltensexperimente an Tieren, für die häufig Mäuse, Ratten oder Insekten eingesetzt werden. Die Verfahren sind auch zur Untersuchung neurologischer Erkrankungen und zur Diagnose von Gehirntumoren geeignet.
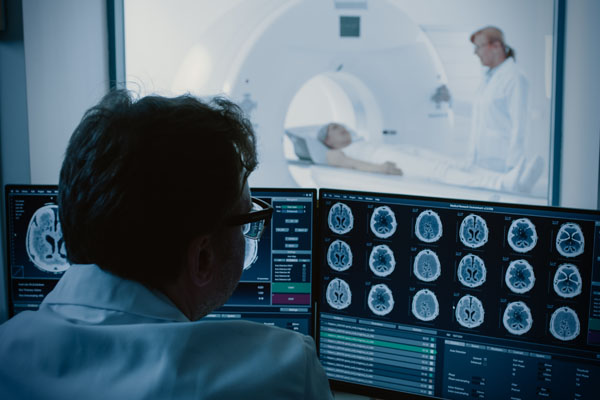
Bei der Computertomografie und anderen tomografische Verfahren werden Organe als dreidimensionales Gesamtbild dargestellt.
Ein häufiger Kritikpunkt, der bzgl. humaner Zellkulturmodelle oder auch Multi-Organ-Chips geäußert wird, ist das Fehlen eines Gesamtorganismus, in dem man systemische Effekte untersuchen kann. Kombiniert man die komplexen humanbasierten Zellmodelle mit Computersimulationen und mit Untersuchungen an Probanden/Patienten unter dem Einsatz moderner bildgebenden Verfahren, so hat man ein umfassendes Portfolio für zuverlässige biomedizinische Untersuchungen zur Verfügung.
5. Ethisch vertretbare Forschung am Menschen
Klinische Studien
Es besteht kein Zweifel daran, dass der lebende Mensch selbst das aussagekräftigste Forschungsobjekt ist, um humanrelevante Daten zu produzieren. Aus diesem Grund sind nicht- oder gering-invasive Humanstudien von unschätzbarem Wert, um wertvolle Erkenntnisse zu gewinnen. Selbstverständlich kann man aber riskante Experimente, beispielsweise die Testung eines neuen Wirkstoffs, nicht direkt am Menschen durchführen. Im Rahmen der Medikamentenentwicklung gibt es klinische Studien am Menschen, die vor der Zulassung eines Wirkstoffs zum Tragen kommen. Bevor die klinischen Studien an menschlichen Probanden gestartet werden, finden zunächst präklinische Vortestungen statt, die zweifelsohne nötig sind, um die menschlichen Testpersonen im Vorfeld bestmöglich abzusichern. Allerdings sind bei diesen präklinischen Testungen im Bereich der Medikamentenentwicklung immer noch Tierversuche vorgeschrieben. Das heißt, erst wenn ein Wirkstoff im Tierversuch als sicher und wirksam befunden wurde, wird er an menschlichen Probanden getestet. Dies birgt für den Menschen ein hohes Risiko, da Tiere häufig ganz anders auf Substanzen reagieren als Menschen. Die Tatsache, dass die Tierversuche kein geeignetes Modell sind, um eine Substanzwirkung beim Menschen vorherzusagen, ist ein Problem, das zunehmend in der Wissenschaftswelt kritisiert wird. Zahlreiche Studien belegen, dass über 90% der Medikamente, die in präklinischen Tierversuchen als sicher und wirksam befunden werden, in den klinischen Studien am Menschen durchfallen (52–54).
Bevölkerungsstudien
Wertvolle Forschungserkenntnisse lassen sich auch mithilfe epidemiologischer Studien (Bevölkerungsstudien) gewinnen, also Untersuchungen an Gruppen von Menschen. Auf diese Weise können die Zusammenhänge zwischen bestimmten Krankheiten und dem Lebensstil sowie den Lebensumständen von Menschen, wie Ernährung, Gewohnheiten und Arbeit, aufgedeckt werden. Insbesondere die Kombination aus epidemiologischen und epigenetischen (die Art und Weise, wie Gene abgelesen werden) Analysen ist ein Forschungsfeld, das sich rasant entwickelt und sehr wertvolle Erkenntnisse für die menschliche Gesundheit liefert (55,56). Aufgrund der Ergebnisse aus epidemiologischen Untersuchungen können wichtige vorbeugende Maßnahmen abgeleitet werden. So wurden auch die krebserregenden Eigenschaften von Tabakrauch und Asbest erkannt. Fleisch- und fettreiche Ernährung, Bewegungsmangel sowie psychosoziale Faktoren konnten aufgrund von Bevölkerungsstudien als Hauptursachen für Diabetes, Krebs und Herz-Kreislauf-Erkrankungen wie Schlaganfall, Herzinfarkt und Arteriosklerose identifiziert werden.
III. Tierversuchsfreie Methoden in der Aus-, Fort- und Weiterbildung
Wer Biologe, Biologielehrer, Arzt oder Tierarzt werden möchte, wird an den meisten deutschen Universitäten gleich zu Beginn seines Studiums mit Tierversuchen bzw. dem sogenannten „Tierverbrauch“ konfrontiert. Darunter versteht man die Verwendung eigens zu Studienzwecken getöteter Tiere oder Teilen von ihnen, Aufschneiden von Tieren sowie Übungen an Organpräparaten, aber auch Versuche an lebenden Tieren sollen den Studierenden Grundbegriffe der Baupläne von Tieren und die Funktion der Organe vermitteln. Im Zoologiepraktikum beispielsweise werden Ratten, Schnecken, Insekten und andere Tiere getötet und aufgeschnitten, um Aussehen und Lage der Organe kennenzulernen. Weit verbreitet sind Tierversuche in der Physiologie, insbesondere sind hier die berüchtigten „Froschversuche“ zu nennen. Den Fröschen wird der Kopf abgeschnitten, dann entnimmt man Organe wie Nerven, Muskeln oder das Herz. Auch abgetrennt vom Körper reagieren die Organe auf Reize wie Stromschläge oder Auftragen bestimmter Medikamente. Seit der italienische Arzt Aloysius Galvani im Jahr 1780 die elektrische Froschmuskelreizung erstmals beschrieb, haben Generationen von Studenten in aller Welt diesen Versuch an Abermillionen von Fröschen durchgeführt.
Dem gegenüber stehen mindestens 1.200 tierversuchsfreie Lehrmittel zur Verfügung (57). Zahlreiche Universitäten setzen bereits auf diese Innovationen, während andere immer noch auf archaischen Methoden beharren.
1. Computersimulationen
Mit modernen Computerprogrammen lassen sich physiologische Phänomene lebensecht nachahmen. Eine Kurve, z. B. zur Reizfrequenz, wird nicht durch den zuckenden Froschmuskel gezeichnet, sondern durch den Computer, nachdem der Studierende verschiedene Parameter im virtuellen Labor eingestellt hat. Viele Programme sind hoch interaktiv und fordern vom Studierenden aktive Mitarbeit. Auf diese Weise wird eine besonders hohe Einprägsamkeit erreicht. Computersimulationen gibt es nicht nur für physiologische Versuche, sondern auch für morphologische Präparationen, pharmakologische Experimente und vieles mehr.
2. Selbstversuche
Die Physiologie kann mit harmlosen Selbstversuchen am eigenen Körper erfahren werden. Die Einprägsamkeit erhöht sich dadurch erheblich. Mit myographischen Verfahren können so Muskelströme und -mechanik z. B. anstatt an einem Froschmuskel am Arm eines Studenten bestimmt werden.
3. Verantwortungsvolle Verwendung toter Tiere
Es ist absolut nicht nötig, für anatomische Studien eigens Tiere zu töten. Schließlich werden für die Anatomiekurse im Studium der Humanmedizin ja auch nicht eigens Menschen umgebracht. In den tierärztlichen Kliniken und Praxen fallen gestorbene oder aus medizinischer Indikation eingeschläferte Tiere an, die für diesen Zweck verwendet werden können. Auch für Biologiestudenten eignen sich natürlich zu Tode gekommene Wirbeltiere oder auch tot aufgefundene Insekten und Regenwürmer.
4. Plastinationen
Bei dem Verfahren der Plastination werden Organe oder ganze Tiere in einen gummiartigen, beliebig lange haltbaren Zustand überführt, ohne dabei Form und Farbe zu verlieren.
5. Simulatoren
Lebensechte Dummies gibt es sowohl für die Human- als auch Tiermedizin. Die „Patienten“ haben einen Puls, Herzschlag, atmen und bluten. Studenten können an ihnen chirurgische Eingriffe, Notfallmaßnahmen und Behandlungen trainieren.
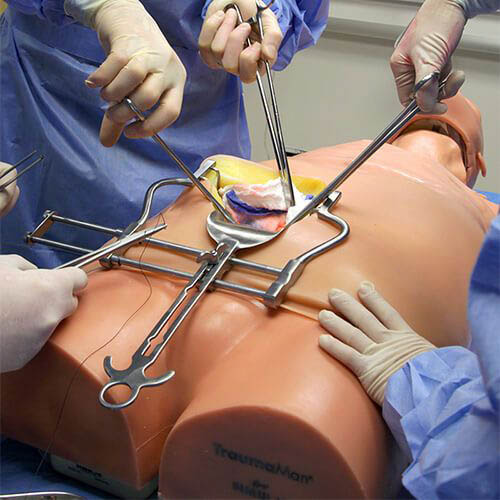
Der TraumaMan ist ein anatomisch korrektes menschliches Modell, das es ermöglicht, eine Vielzahl von chirurgischen Verfahren zu üben. Künstliches Blut kann durch den "Körper" gepumpt werden, so dass das Gewebe blutet, wenn ein Fehler gemacht wird. (Bildquelle: Skils Med Deutschland GmbH)

Das realitätsgetreue, chirurgische menschliche Modell der Firma SynDaver ermöglicht beliebig wiederholbar chirurgische Eingriffe und bietet anpassbare, variable Pathologien mit integriertem Gefäßsystem. (Bildquelle: SynDaver)
6. Virtual Reality
Virtual Reality für Chirurgen funktioniert wie ein Flugsimulator in der Pilotenausbildung. Eine Echtzeit-Simulation mit Videoaufnahmen aus echten OPs und haptischer Wahrnehmung, d.h. der Chirurg fühlt, wenn er mit den Instrumenten auf Gewebe trifft, es schneidet, mit der Pinzette zieht oder schiebt. Das Simulationsprogramm rechnet das Tastgefühl um und präsentiert auf dem Bildschirm entsprechende Bilder aus einer riesigen Videodatenbank.
7. Lernen am Patienten
Studierende der Tiermedizin können Behandlungen und diagnostische Untersuchungen (EKG, Blutentnahme, Reflexe usw.) an Tierpatienten erlernen, so wie es auch in der Humanmedizin üblich ist.
8. Assistieren
Operieren lernt ein angehender Arzt zunächst durch Übungen an menschlichen Leichen und ein Tierarzt an toten, auf natürliche Weise gestorbenen oder aus medizinischer Indikation eingeschläferten Tieren. Im nächsten Schritt erfolgt das Assistieren bei einem erfahrenen Chirurgen, bis man schließlich in der Lage ist, selbst Operationen – zunächst unter Aufsicht – am Patienten vorzunehmen. So lässt sich das chirurgische Handwerk sinnvoll erlernen.
IV. Validierung tierversuchsfreier Methoden
Unter Validierung versteht man die wissenschaftliche Überprüfung einer Forschungsmethode für ihren praktischen Einsatz. Dabei wird sie in langwierigen und aufwendigen Verfahren unter anderem auf ihre Zuverlässigkeit, Wiederholbarkeit und Vorhersagekraft beispielsweise schädlicher Wirkungen überprüft.
Es ist ein Kritikpunkt, den man häufig von Tierversuchsverfechtern hört: Die tierversuchsfreien Forschungsmethoden seien nicht validiert. Das ist schlichtweg eine Falschaussage. Zahlreiche solcher Verfahren wurden bereits erfolgreich validiert. Was nachweislich jedoch nie validiert wurde, sind die Tierversuche. Würden die tierversuchsfreien Methoden eine so schlechte Voraussagekraft und Reproduzierbarkeit an den Tag legen wie Tierversuche, dann würden sie keine Validierung überstehen. Und würden Tierversuche dem Validierungsprozedere bei tierversuchsfreien Methoden unterzogen werden, würden sie durchfallen und dürften nicht zur Anwendung kommen.
1. Wozu werden Forschungsmethoden validiert?
Validierung tierversuchsfreier Testverfahren ist ein großes Thema, wenn es darum geht, diese Methoden als sogenannte „Alternativen zum Tierversuch“ zu etablieren und für regulatorische, also gesetzlich vorgeschriebene, Testungen zu akzeptieren. Die tierversuchsfreie Methode muss von der Europäischen Kommission und der Organisation for Economic Cooperation and Development (OECD), einem Zusammenschluss der wichtigsten Industrienationen, akzeptiert werden, damit das Produkt bzw. der Test offiziell als „Alternative zum Tierversuch“ deklariert wird. Der Weg zur regulatorischen Akzeptanz eines Testverfahrens ist lang und steinig. Die Prozedur erstreckt sich über viele festgelegte Schritte und etliche Gremien prüfen und entscheiden nach diversen Kriterien, ob die jeweilige Methode geeignet ist oder nicht (58). Die Validierung des Tests ist hierbei nur der erste Schritt, gefolgt von weiteren Stufen, die der Test durchlaufen muss, bevor er letztendlich regulatorisch akzeptiert wird. Die Validierung an sich ist hier bereits ein strikter Prozess, der exakte Kriterien erfüllen muss, die vom ECVAM und der OECD festgelegt sind (59).
Unsere NAT-Database (Siehe S. 1) bietet die Möglichkeit, nach validierten Methoden zu filtern. Diese machen nur einen Bruchteil aller Datenbank-Einträge aus, was die Realität widerspiegelt. Grundsätzlich werden nämlich die meisten tierversuchsfreien Methoden, die weltweit entwickelt werden, nicht validiert. Sie dienen häufig der akademischen bzw. Grundlagenforschung, bei der eine Validierung einer Forschungsmethode i.d.R. nicht im Vordergrund steht, sondern der wissenschaftliche Neuwert. Forschungsmodelle und -methoden sind hier nur Mittel, um wissenschaftliche Sachverhalte zu erforschen.
2. Wer ist zuständig für die Validierung von Forschungsmethoden?
Zuständig für die Validierung von „Alternativmethoden zum Tierversuch“ in Europa ist das ECVAM, das European Center for the Validation of Alternative Methods (60). Seine Aufgabe ist es, den Weg der tierversuchsfreien Verfahren hin zur regulatorischen Akzeptanz zu begleiten und zu koordinieren, so dass sie bei Sicherheitstestungen anstelle von bislang vorgeschriebenen Tierversuchen eingesetzt werden können. Im außereuropäischen Ausland gibt es analoge Institutionen, die eng mit dem ECVAM zusammenarbeiten, ebenso erfolgt ein stetiger Abgleich mit der OECD. Das ist in Anbetracht unserer globalisierten Wirtschaft sehr wichtig, damit im Idealfall Behörden weltweit eine Testmethode als „Alternative zum Tierversuch“ akzeptieren, wenn es beispielsweise um die Registrierung einer Chemikalie oder die Entwicklung eines neuen Produktes geht. Das ECVAM ist Teil des JRC (Joint Research Center) und untersteht der Europäischen Kommission.
3. Wie läuft die Validierung ab?
Wird eine tierversuchsfreie Testmethode beim ECVAM angemeldet, erfolgt vor Beginn des Validierungsverfahrens zunächst eine Konsultierung mehrerer Gremien und Gruppen von Interessensvertretern (sog. Stakeholdern), die die Relevanz der Methode bewerten. Erst im Anschluss daran startet ggf. der extrem aufwendige Validierungsprozess, der einer Art Qualitätssicherung gleicht. Hierbei gibt das ECVAM konkrete experimentelle Kriterien vor, die der Test erfüllen muss. Es handelt sich um strikte Anforderungen, durch die die Zuverlässigkeit des Testverfahrens belegt wird und die gewährleisten sollen, dass der Test immer gleichbleibende Ergebnisse produziert, egal, von wem und wo er durchgeführt wird. Das heißt, die Ergebnisse müssen eine gewisse Reproduzierbarkeit aufweisen oder in verschiedenen Laboratorien dieselben Ergebnisse liefern.
Durchgeführt werden die Validierungsstudien i.d.R. in den eigenen Laboren des ECVAM oder in den ca. 40 akkreditierten Laboren, die mit dem ECVAM zusammenarbeiten, den sog. NETVAL-Laboratorien (Network of Laboratories for the Validation of Alternative Methods), die sich an verschiedenen Standorten in Europa, auch in Deutschland, befinden (61). Im Anschluss an die Validierung werden die Ergebnisse von dem wissenschaftlichen Expertenkomitee ESAC (ECVAM Scientific Advisory Committee) begutachtet. Letztendlich erstellt das ECVAM in Zusammenarbeit mit weiteren Gremien aus Interessensvertretern und Experten eine Empfehlung zu einer Methode, die dann veröffentlicht und auch der Europäischen Kommission vorgelegt wird. Diese Empfehlung ist wohlgemerkt nicht verpflichtend oder gesetzlich bindend, sollte aber von Entscheidungsträgern und Behörden in den Mitgliedsstaaten berücksichtigt und adaptiert werden.
4. Wo liegen die Probleme?
Der letzte Schritt nach erfolgreicher Validierung einer Methode ist schließlich die offizielle regulatorische Akzeptanz eines Verfahrens als „Alternative zum Tierversuch“. Diese Methode kann dann für bestimmte Testungen im regulatorischen Bereich anstelle von Tierversuchen eingesetzt werden, z.B. wenn es darum geht, zu prüfen, ob eine bestimmte Chemikalie die Haut reizt. Das Problem ist hier, dass die zuständigen europäischen Behörden diese Tests i.d.R. zwar auch akzeptieren, jedoch gibt es nicht für all die zahlreichen Testkriterien, die untersucht werden müssen, tierversuchsfreie Verfahren, die anstelle von Tierversuchen akzeptiert werden. Es ist also noch weitere Etablierungsarbeit nötig, um die Testung an Tieren komplett zu verbannen.
Der gesamte Validierungsprozess bis zur behördlichen Anerkennung und Aufnahme in Rechtsvorschriften dauert etliche Jahre. Es kommt leider vor, dass selbst validierte und anerkannte tierversuchsfreie Verfahren oftmals parallel zum Tierversuch geführt werden, wie z.B. beim Pyrogentest (62).

Pyrogentest
Seit mehr als 100 Jahren werden Arzneimittel, Impfstoffe und andere Substanzen standardmäßig auf fieberauslösende Verunreinigungen (sog. Pyrogene) überprüft, indem die Testsubstanz Kaninchen injiziert wird, um mögliche Fieberreaktionen zu erkennen. Die Tiere werden dabei so fixiert, dass sie sich nicht bewegen können. Bereits in den 1990er Jahren wurde von Wissenschaftlern der Universität Konstanz ein tierversuchsfreier Pyrogentest entwickelt, der mit menschlichem Blut arbeitet. Dieser Monozyten Aktivierungstest (MAT) ist nicht nur aus ethischen Gründen dem Tierversuch überlegen, sondern es lässt sich damit auch eine viel größere Bandbreite an Verunreinigungen aufspüren (63). Der Test wurde 2005 international validiert und 2009 in das Europäische Arzneibuch aufgenommen – allerdings parallel zum Kaninchentest. Der MAT muss produktspezifisch validiert werden, d.h. ein aufwendiges Überprüfungsverfahren für jedes Produkt durchlaufen, während dies vom Kaninchentest nicht verlangt wird. Ein drastisches Beispiel dafür, dass bei der Anerkennung von tierversuchsfreien Methoden mit zweierlei Maß gemessen wird. 2021 kündigte die EU-Behörde EDQM an, den Kaninchentest innerhalb von 5 Jahren auslaufen zu lassen – endlich!
Fotoquelle: unoL-shutterstock.com)
Viele tierversuchsfreie In-vitro-Tests wurden validiert und regulatorisch akzeptiert, als von der EU ein Verbot von Tierversuchen im Bereich Kosmetik erlassen wurde (64). Dieses Verbot trat 2013 in Kraft und der Sachverhalt ist ein gutes Beispiel dafür, wie wichtig es ist, klare gesetzliche Verbote zur Abschaffung von Tierversuchen auszusprechen, um die tierversuchsfreie Forschung und deren regulatorische Akzeptanz voranzutreiben.
Das Scheitern des 3R-Konzepts
Im Jahr 1959 wurde von den britischen Forschern William Russell und Rex Burch das sogenannte 3R-Konzpet vorgestellt. Die 3R stehen für:
- Replacement (Ersatz): Der Tierversuch wird durch eine tierversuchsfreie Methode ersetzt.
- Reduction (Reduzierung): Anstelle des herkömmlichen Tierversuchs wird eine Methode eingesetzt, die die Anzahl der Versuchstiere verringert.
- Refinement (Verfeinerung): Maßnahmen, die die Leiden der Tiere vermindern. Aber auch verbesserte Haltungsbedingungen zählen hierzu.
Dieses Konzept beruht auf der Annahme, der Tierversuch sei eine prinzipiell sinnvolle Methode. Eine Abkehr von ihr wird nicht in Erwägung gezogen. Für Tierversuchsgegner sind die Rs Reduction und Refinement indiskutabel. Selbst der Ersatz (Replacement) ist nur bedingt zu akzeptieren, impliziert er doch, dass der Tierversuch im Prinzip eine geeignete Methode sei, die lediglich ersetzt zu werden braucht, um zu relevanten Ergebnissen für den Menschen zu gelangen.
Tatsächlich sind Tierexperimente nicht nur aus ethischen Gründen abzulehnen, sondern auch aufgrund der mangelnden Übertragbarkeit auf den Menschen. Dieser wissenschaftskritische Aspekt wird bei der 3R-Philosophie nicht berücksichtigt. In Wissenschaftskreisen wird auch von „Alternativmethoden“ oder „Ersatz- und Ergänzungsmethoden“ gesprochen. Auch diese Formulierungen sind irreführend, da tierversuchsfreie Methoden keinen bloßen Ersatz, sondern gute Wissenschaft darstellen. mehr >>
5. Welche validierten Forschungsmethoden gibt es bereits?
Im Rahmen des Verbots von Tierversuchen für Kosmetikprodukte sind insbesondere viele Tests an humanen 3D-Zellkulturmodellen bzw. Gewebemodellen validiert worden. Hierzu zählen z.B. 3-dimensionale Modelle der menschlichen Haut (65), des Auges (66) und der Atemwege (67). Bei diesen Tests befinden sich die komplexen Zellmodelle in einer Zellkulturplatte und die zu testende Substanz kann einfach aufgebracht werden. In den meisten Fällen wird über ein Photometer eine Farbreaktion nachgewiesen, deren Intensität das Ausmaß der Schädigung der Zellen durch die Testsubstanz widerspiegelt. Von all diesen Modellen gibt es mittlerweile auch regulatorisch akzeptierte Tests, die eingesetzt werden können, um geforderte Testkriterien wie Augenreizung, Hautreizung, Reizung der Atemwege etc. nachzuweisen, ohne dass Tierversuche zum Einsatz kommen müssen.
Eine detaillierte Übersicht aller Testmethoden, die bereits akzeptiert sind oder sich aktuell im Validierungsprozess befinden, findet man in der Datenbank TSAR (Tracking System for Alternative Methods towards Regulatory Acceptance) (68). Auch hier ist jedoch Vorsicht geboten, denn nicht all diese Methoden sind tatsächlich frei von tierischen Geweben oder Komponenten, es ist lediglich garantiert, dass nicht an lebenden Tieren getestet wird.
Insbesondere im Bereich der Sicherheitstestung von Chemikalien sind die computerbasierten Verfahren (in silico) hervorzuheben (49). Sie haben sich als validierte und regulatorisch akzeptierte „Alternativmethoden zum Tierversuch“ durchaus etabliert und kommen mittlerweile häufig zum Einsatz, wenn es z.B. um die Zulassung von Chemikalien geht bzw. darum abzuschätzen, ob die Substanz schädliche Auswirkungen auf den menschlichen Organismus haben könnte.
6. Was muss sich in Zukunft verbessern?
Trotz der steigenden Zahl von validierten Methoden, die tierversuchsfreie Testungen ermöglichen, wird leider bei der Validierung mit zweierlei Maß gemessen. Die Tierversuche sind im regulatorischen Bereich immer noch das Maß der Dinge, der sogenannte Goldstandard, an dem sich die humanbasierten tierversuchsfreien Methoden zu allem Übel auch noch messen müssen. Und das, obwohl bekannt und wissenschaftlich vielfach belegt ist, dass die Vorhersagekraft der Tierversuche – auch bei Sicherheitsprüfungen und toxikologischen Untersuchungen – schlecht ist. Warum soll ein innovatives Testverfahren, das auf humanen Zellen basiert und somit logischerweise den Menschen besser widerspiegelt, seine Tauglichkeit an Tierversuchen unter Beweis stellen? Das ist absurd und auch ein Dilemma bei strategischen Überlegungen zur Abschaffung von Tierversuchen im regulatorischen Bereich. Aus dem Grund sprechen wir auch nicht von „Alternativen“, bzw. setzen den Begriff in diesem Artikel in Anführungszeichen, denn eine „Alternative“ impliziert, dass etwas Gleichwertiges ersetzt wird. Humanbasierte Methoden sind aber nicht gleichwertig, sondern besser.
Es muss ein generelles Umdenken stattfinden, weg vom klassischen „Ersetzen“ vorgeschriebener Tierversuche, denn genau so wird es eben nicht funktionieren. Laut der europäischen Chemikalienagentur ECHA sind bestimmte Tierversuche mittlerweile recht gut oder gar vollständig „durch Alternativmethoden zu ersetzen“, komplexere Untersuchungen jedoch noch nicht (69). Beispielsweise sei es schwierig, einen 90-Tage-Toxizitätstest bei einer Ratte in vitro zu simulieren. Das ist aber genau die falsche Herangehensweise. Es darf nicht das Ziel sein, einen aktuell verwendeten nachweislich unzuverlässigen Rattentest in vitro zu simulieren, sondern man muss im Fokus behalten, dass man das toxische Langzeitpotenzial einer Substanz beim Menschen untersuchen will. Wer sagt, dass der klassische 90-Tage-Test, bei der die Ratte jeden Tag (!) eine potenziell giftige Substanz oral per Schlundsonde verabreicht bekommt, die Methode der Wahl ist? Auch dieser Test wurde nie validiert, sondern hat sich einfach etabliert und wird nun seit Jahrzehnten standardmäßig durchgeführt. Würde man eine korrekte Validierung dieses Verfahrens vornehmen, würde er mit höchster Wahrscheinlichkeit durchfallen, denn die Fehleranfälligkeit des Tests und die mangelnde Übertragbarkeit auf den Menschen sind nicht von der Hand zu weisen.
Handlungsbedarf
Leider haben weder die EU noch Deutschland bisher eine konkrete Strategie entwickelt, um Tierversuche (zumindest regulatorische) vollständig durch tierversuchsfreie Methoden abzuschaffen. Gut und erfreulich ist aber, dass offen und kritisch darüber diskutiert wird, und zwar mit allen beteiligten Interessensvertretern inklusive NGOs, europäischen Behörden und Entscheidungsträgern. Auch wir zeigen zusammen mit unseren europäischen Dachverbänden ECEAE (European Coalition to End Animal Experiments) und Eurogroup for Animals den Handlungsbedarf auf, konkrete Ideen und Strategien zu entwickeln, damit Entscheidungsträger auf nationaler und europäischer Ebene die Abschaffung der Tierversuche klar fokussieren. Hierzu gehören vor allem zwei Dinge: den innovativen tierversuchsfreien Methoden das wohlverdiente Vertrauen zu schenken und zudem die Augen nicht davor zu verschließen, dass Tierversuche aufgrund ihrer mangelnden Aussagekraft nicht das Forschungsmodell der Zukunft sein dürfen.
7. Werden tierversuchsfreie Methoden ausreichend gefördert?
Tatsächlich gibt es in Deutschland kaum staatliche Fördergelder, die die dringend notwendige Validierung tierversuchsfreier Methoden finanzieren. Meist sind es Unternehmen, die große Summen für Validierung investieren, wenn sie Interesse an einer bestimmten Methode haben. Die Pharmaindustrie könnte bis zu 600 Millionen Euro bei der Entwicklung eines einzigen Medikaments einsparen, wenn man auf die neuen Verfahren zurückgreifen würde (70). Wieviel Geld in die Förderung tierversuchsfreier Forschung investiert wird, wird von den staatlichen Förderstellen und Forschungsgesellschaften nicht öffentlich mitgeteilt. Detaillierte Recherchen zeigen, dass unter 1% der staatlichen Fördergelder in der Forschung für tierversuchsfreie Methoden eingesetzt werden und über 99% immer noch in Projekte fließen, die Tierversuche beinhalten (71). Solange sich dieses Ungleichgewicht nicht drastisch ändert, wird es schwierig bleiben, in Deutschland die tierversuchsfreie Forschung in dem Maß zu etablieren, wie es nötig ist.
V. Paradigmenwechsel hin zu einer tierversuchsfreien Forschung
Tierversuchsfreie Forschung hat es nicht zuletzt so schwer, sich durchzusetzen, weil die Tierversuche seit Jahrzehnten ihren festen Platz in der Gesellschaft haben. Das Bild von Tierversuchen, die nicht zu ersetzen sind, weil sie unerlässlich für die Sicherheit der Menschen seien, wird hartnäckig aufrechterhalten und es werden Ängste bei der Bevölkerung geschürt. Wissenschaftlich fundierte Beweise, die dieses Bild klar widerlegen werden ignoriert und totgeschwiegen. Daher ist es so wichtig, Aufklärungsarbeit zu leisten und mit unbegründeten Dogmen aufzuräumen, damit ein Paradigmenwechsel hin zu einer tierversuchsfreien Wissenschaft und Forschung erreicht werden kann.
1. Warum werden Tierversuche überhaupt noch gemacht?
Wenn Tierversuche so schlechte Ergebnisse liefern und tierversuchsfreie Forschung so viel besser ist, warum müssen dann immer noch so viele Tiere in Versuchen sterben?
- Seit mehr als 150 Jahren gilt die Methode Tierversuch in der Wissenschaft als „Goldstandard“, ohne dass sie jemals auf ihre medizinisch-wissenschaftliche Relevanz hin überprüft oder validiert worden ist.
- In die Tierversuchsforschung fließen enorme Summen in Form von Forschungsgeldern, Drittmitteln oder Stipendien.
- Nur mit einer langen Liste von Veröffentlichungen in hochrangigen Fachzeitschriften kann man sich in der Welt der Wissenschaft einen Namen machen. Diese verlangen häufig Tierversuche.
- Rund die Hälfte aller Tierversuche werden im Rahmen der Grundlagenforschung durchgeführt. Diese dient dem Zugewinn von Wissen ohne konkreten Bezug zur medizinischen Notwendigkeit oder gezielten Anwendungen.
- Etwa ein Viertel der Tierversuche sind für Sicherheitstestungen und Medikamentenentwicklung aktuell gesetzlich vorgeschrieben.
- Eine ganze Industrie profitiert vom Tierversuch. Züchter, Händler, Futterlieferanten, Hersteller von Käfigen und Zubehör usw. – sie alle verdienen an Tierversuchen.
2. Spiegeln Tiere den Menschen wirklich wider?
Tierversuche sind kein effektives Forschungsmodell, um menschliche Krankheiten zu erforschen oder die Wirkung von Substanzen auf den menschlichen Körper vorherzusagen. Tiere unterscheiden sich stark von der menschlichen Physiologie und reagieren anders auf Substanzen als der Mensch (Tabelle 1). Aufgrund der mangelnden Übertragbarkeit der Versuchsergebnisse von Tieren auf den Menschen sind tierexperimentelle Daten grundsätzlich unzuverlässig und stellen ein Sicherheitsrisiko für den Menschen dar. Viele der menschlichen Krankheiten, die an ihnen erforscht werden, würden Tiere von Natur aus gar nicht entwickeln, beispielsweise Diabetes, Alzheimer, Parkinson oder zahlreiche Krebserkrankungen. Aus diesem Grund werden absurde Tiermodelle geschaffen, indem bei gesunden Tiere durch simple gentechnische Modifikationen oder absurde Versuchsaufbauten Krankheiten simuliert werden (Tabelle 2). Solche Ansätze sind zum Scheitern verurteilt, da man komplexe menschliche Erkrankungen, die über Jahre oder Jahrzehnte hin entstehen und an deren Entwicklung zahlreiche Einflussfaktoren beteiligt sind, nicht durch stark vereinfachte künstliche Veränderungen in Tieren abbilden kann.
Um die medizinische Forschung zuverlässiger und effizienter zu gestalten, ist es also unbedingt notwendig, neue tierversuchsfreie Modelle zu etablieren, die humanbasiert sind und valide Daten liefern.
3. Gäbe es ohne Tierversuche keinen medizinischen Fortschritt?
Tierversuchsbefürworter heben häufig hervor, dass Tierversuche an der Entwicklung zahlreicher Medikamente beteiligt waren. Da erfolgreich absolvierte Tierversuche die Voraussetzung dafür sind, dass ein Medikament überhaupt den Zulassungsprozess weiter durchlaufen kann, sind sie zwangsläufig an dessen Entwicklung beteiligt. Dies heißt aber noch lange nicht, dass das Medikament nicht ohne die Tierversuche hätte entwickelt werden können. Darüber hinaus sind Tierversuche sogar hinderlich, weil sie die Forschung in die falsche Richtung lenken. Studien zeigen auf, dass über 90% der Medikamente, die sich im Tierversuch als sicher und wirksam erwiesen haben, nicht auf den Markt kommen (52–54). Die Hauptursache dafür ist, dass die Wirkstoffe in den klinischen Studien am Menschen dann doch teils schwere oder tödliche Nebenwirkungen aufweisen oder schlichtweg nicht wirken, wie man es sich erhofft hatte (72–75). Hinzu kommt die Gefahr, dass viele Medikamente im Tierversuch aufgrund fehlender Wirksamkeit oder unerwünschter Nebenwirkungen aussortiert werden, die aber beim Menschen vielleicht wirksam und unproblematisch wären. Viele wichtige Medikamente wie Aspirin, Ibuprofen oder Penicillin wären uns vorenthalten geblieben, hätte man sich schon in früheren Zeiten auf den Tierversuch verlassen. Diese Stoffe rufen nämlich bei bestimmten Tierarten aufgrund unterschiedlicher Stoffwechselvorgänge gravierende Schädigungen hervor (Tabelle 1). Als diese Arzneien vor langer Zeit entdeckt wurden, gab es noch keine verpflichtende Testung in Tieren. Bei der heutigen Vorgehensweise wären sie bei der Wirkstofffindung durchgefallen.
Auch wirtschaftlich würde sich ein Umstieg auf tierversuchsfreie Forschungsmethoden rentieren, wie immer mehr Studien aufzeigen (4,7,76), denn die modernen Verfahren sind kostengünstiger und schneller als langwierige Tierversuche, zudem sind sie hochdurchsatzfähig, d.h. riesige Mengen von Substanzen können parallel getestet werden.
Würde man anstelle von Tierversuchen moderne humanbasierte Modelle einsetzen, würde der medizinische Fortschritt also nicht zum Erliegen kommen, sondern mit Sicherheit einen deutlichen Aufschwung erfahren.
Tabelle 1
|
Beispiele für unterschiedliche Reaktionen von Mensch und Tier auf verschiedene Substanzen |
||
|
Substanz |
Mensch |
Tier |
|
Asbest |
Krebs |
verträglich für Ratten, Hamster |
|
Arsen |
giftig |
gut verträglich für Schafe |
|
Contergan |
Missbildungen |
keine Missbildungen bei Tieren (aßer bestimmten Affenarten und Kaninchen) |
|
Cortison |
verträglich |
Missbildungen bei Mäusen |
|
Morphium |
beruhigend |
stimulierend bei Katze, Rind, Pferd |
|
Penicillin |
gut verträglich |
schädlich für Meerschweinchen, Hamster |
|
Paracetamol |
gut verträglich |
giftig für Katzen |
|
Phenobarbital |
gut verträglich |
Leberkrebs bei Ratten |
|
Saccharin |
gut verträglich |
Blasenkrebs bei männlichen Ratten |
Tabelle 2
|
So wird in "Tiermodellen" versucht, menschliche Krankheiten nachzuahmen |
||
|
Krankheit |
Typische Tierart |
Manipulation |
|
Alzheimer |
Maus |
Genmanipulation |
|
Bauchfellentzündung |
Maus |
Löcher in den Darm stechen, so dass Darminhalt in die Bauchhöhle gelangt |
|
Blutvergiftung |
Schwein |
Injektion von Bakterien in die Blutbahn |
|
Depression |
Maus, Ratte |
Schwimmen bis zur Verzweiflung, Stromstöße oder am Schwanz aufhängen |
|
Diabetes |
Ratte |
Injektion eines Giftes zerstört die Inselzellen in der Bauchspeicheldrüse, so dass kein Insulin mehr produziert wird |
|
Epilepsie |
Ratte |
Giftinjektion ins Gehirn oder Stromstöße |
|
Herzinfarkt |
Hund, Ratte |
Zuziehen einer Schlinge um eine Herzkranzarterie |
|
Krebs |
Maus |
Genmanipulation oder Injektion von Krebszellen |
|
Magersucht |
Ratte |
Halbierte Futterration, bis das Tier 55% seines Gewichts abgenommen hat |
|
Multiple Sklerose |
Maus |
Auslösen einer gegen den eigenen Körper gerichteten Immunreaktion durch Injektion von Eiweißen und Mineralöl |
|
Parkinson |
Maus, Ratte, Affe |
Nervengiftinjektion ins Gehirn lässt bestimmte Hirnzellen absterben |
|
Rheuma |
Ratte |
Injektion von Chemikalien oder Bakterien ins Gelenk |
|
Schlaganfall |
Maus, Ratte |
Verstopfen einer Hirnarterie mittels eines Fadens |
25.05.2023
Aktualisiert 14.04.2025
Dr. Tamara Zietek
Weitere Infos
NAT-Database - die Datenbank zu tierversuchsfreien Forschungsmethoden >>
Flyer „Forschung ohne Tierleid“ - Im Shop bestellen >>
oder als PDF kostenlos herunterladen >>
Broschüre „Woran soll man denn sonst testen - Moderne Forschungsmethoden ohne Tierversuche“ - Im Shop bestellen >>
oder als PDF kostenlos herunterladen >>
Quellen
- Pound P., Bracken M.B. Is animal research sufficiently evidence based to be a cornerstone of biomedical research? BMJ 2014; 348:g3387–g3387
- Pound P. et al. Where is the evidence that animal research benefits humans? BMJ. 2004; 328(7438):514–7
- van der Worp H.B. et al. Can Animal Models of Disease Reliably Inform Human Studies? PLoS Medicine. 2010; 7(3):e1000245
- Meigs L. et al. Animal testing and its alternatives – the most important omics is economics 2018; 35(3):275–305
- New approach methods work plan: Reducing use of animals in chemical testing. USEPA 2020
- Netherlands national Committee for the Protection of animals used for scientific purposes: NCad opinion Transition to non-animal research. 2016
- A non-animal technologies roadmap for the UK: Advancing predicitive biology. 2015
- Eurogroup for animals: Norwegian National Experimental Animals Committee proposes steps to develop a concrete plan for a transition to non-animal science. News. 2020
- Ärzte gegen Tierversuche e.V.: Förderung von Tierversuchen und tierversuchsfreier Forschung. 03.05.2021
- Hartung T. Predicting toxicity of chemicals: software beats animal testing. EFSA Journal 2019; 17(S1):e170710
- Noorden R.V. Software beats animal tests at predicting toxicity of chemicals. Nature 2018; 559:163
- Passini E. et al. Human in silico drug trials demonstrate higher accuracy than animal models in predicting clinical pro-arrhythmic cardiotoxicity. Front Physiol 2017; 8:668
- Sato T. et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 2011; 141(5):1762–72
- Spence J.R. et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature 2011; 470(7332):105–9
- Lancaster M.A. et al. Cerebral organoids model human brain development and microcephaly. Nature 2013; 501(7467):373–9
- Takebe T., Wells J.M. Organoids by design. Science 2019; 364(6444):956–9
- Mithal A. et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nat Commun 2020; 11(1):1–15
- van de Wetering M. et al. Prospective derivation of a Living Organoid Biobank of colorectal cancer patients. Cell 2015; 161(4):933–45
- Schwank G. et al. Functional repair of CFTR by CRISPR/Cas9 in Intestinal Stem Cell Organoids of Cystic Fibrosis Patients. Cell Stem Cell 2013; 13(6):653–8
- Fujii M. et al. Modeling human digestive diseases with CRISPR-Cas9-modified organoids. Gastroenterology 2019; 156(3):562–76
- Clevers H. Modeling Development and Disease with Organoids. Cell 2016; 165(7):1586–97
- Tcw J. Human iPSC application in Alzheimer’s disease and Tau-related neurodegenerative diseases. Neurosci Lett 2019; 23(699):31–40
- Burbulla L.F. et al. Dopamine oxidation mediates mitochondrial and lysosomal dysfunction in Parkinson’s disease. Science 2017; 357(6357):1255–61
- Noh H. et al. Modeling schizophrenia pathogenesis using patient-derived induced pluripotent stem cells (iPSCs). Biochim Biophys Acta 2017; 1863(9):2382–7
- Grunwald L.-M. et al. Comparative characterization of human induced pluripotent stem cells (hiPSC) derived from patients with schizophrenia and autism. Translational Psychiatry 2019; 9(179):1–11
- Victor M.B. et al. Striatal neurons directly converted from Huntington’s disease patient fibroblasts recapitulate age-associated disease phenotypes. Nat Neurosci 2018; 21(3):341–52
- Veening-Griffioen D.H. et al. Are some animal models more equal than others? A case study on the translational value of animal models of efficacy for Alzheimer’s disease. European Journal of Pharmacology 2019; 859:172524
- Cummings J.L. et al. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures. Alzheimers Res Ther 2014; 6(4):37
- Cummings J. Lessons Learned from Alzheimer Disease: Clinical Trials with Negative Outcomes. Clin Transl Sci 2018; 11(2):147–52
- Negraes P.D. et al. Modeling anorexia nervosa: transcriptional insights from human iPSC-derived neurons. Transl Psychiatry 2017; 7(3):e1060
- Plummer S. et al. A Human iPSC-derived 3D platform using primary brain cancer cells to study drug development and personalized medicine. Nature Scientific Reports 2019; 9(1407)
- Halfter K., Mayer B. Bringing 3D tumor models to the clinic - predictive value for personalized medicine. Biotechnol J 2017; 12(2)
- Tuveson D., Clevers H. Cancer modeling meets human organoid technology. Science 2019; 364(6444):952–5
- Ooft S.N. et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Sci Transl Med 2019; 11(513):e2574
- Kim M., Mun H. et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nat Commun 2019; 10(1):1–15
- Ng W.L. et al. Skin Bioprinting: Impending Reality or Fantasy? Trends Biotechnol 2016; 34(9):689–99
- Berg J., Kurreck J. Clean bioprinting - Fabrication of 3D organ models devoid of animal components. ALTEX 2021; 38(2)
- Anas Essop. Korean bioprinting startup develops 3D respiratory epithelium model for virus research. 3D Printing Industry 2020
- Lansdowne L.E. Using Bioprinted Tissue Models To Test Drugs Against Diseases Including COVID-19. Drug Discovery from Technology Networks 2020
- Augustine R. Skin bioprinting: a novel approach for creating artificial skin from synthetic and natural building blocks. Prog Biomater 2018; 7(2):77–92
- Park S.E. et al. Organoids-on-a-chip. Science 2019; 364(6444):960–5
- Kolanowski T.J. et al. Enhanced structural maturation of human induced pluripotent stem cell-derived cardiomyocytes under a controlled microenvironment in a microfluidic system. Acta Biomater 2020; 102:273–86
- Bauer S. et al. Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model. Sci Rep 2017; 7(1):1–11
- Rogal J. et al. Stem-cell based organ-on-a-chip models for diabetes research. Advanced Drug Delivery Reviews. 2019; 140:101–28
- Edington C.D. et al. Interconnected Microphysiological Systems for Quantitative Biology and Pharmacology Studies. Sci Rep 2018; 8(1):4530.
- Johnson M. Tissue Chips in Space a Big Leap for Research. NASA. 9.11.2018
- More S..et al. Animal welfare aspects in respect of the slaughter or killing of pregnant livestock animals (cattle, pigs, sheep, goats, horses). EFSA AHAW 2017; 15(5):55
- Fetal Calf Serum Free Database. https://fcs-free.sites.uu.nl/ (abgerufen am 4.5.2021)
- Dura A. Alternative methods for toxicity testing: Computational Methods. EU Science Hub - European Commission 2018
- Touska P., Connor S.E.J. Recent advances in MRI of the head and neck, skull base and cranial nerves: new and evolving sequences, analyses and clinical applications. Br J Radiol 2019; 92(1104):20190513
- Aziz W. et al. Emerging role of cardiac computed tomography in heart failure. ESC Heart Fail 2019; 6(5):909–20
- Thomas D.W. et al. Clinical Development Success Rates 2006-2015. BIO Industry Analysis. June 2016
- Mullard A. Parsing clinical success rates. Nat Rev Drug Discov 2016; 15(447)
- Wong C.H. et al. Estimation of clinical trial success rates and related parameters. Biostatistics 2019; 20(2):273–86
- Mill J., Heijmans B.T. From promises to practical strategies in epigenetic epidemiology. Nat Rev Genet 2013; 14(8):585–94
- Bakulski K.M., Fallin M.D. Epigenetic epidemiology: promises for public health research. Environ Mol Mutagen. 2014; 55(3):171–83
- InterNICHE-Alternativendatenbank. https://interniche.org/de/alternatives (abgerufen am 4.5.2021)
- Bingham M. Validation and submission process. EU Science Hub - European Commission 2017
- Guidance document on the validation and international acceptance of new or updated test methods for hazard assessment. OECD 2005; 34
- O’Connor L. EU Reference Laboratory for alternatives to animal testing. EU Science Hub - European Commission 2017
- Bingham M. EU-NETVAL (European Union Network of Laboratories for the Validation of Alternative Methods). EU Science Hub - European Commission 2017
- Gericke C. Pyrogentest - Unendlich viel Tierleid trotz vorhandener tierversuchsfreier Methoden. Ärzte gegen Tierversuche e.V., 06.07.2020
- Hartung T. The human whole blood pyrogen test - lessons learned in twenty years. ALTEX. 2015; 32(2):79–100
- Ärzte gegen Tierversuche e.V. Aus für Kosmetik-Tierversuche! 12.03.2013
- SkinEthic RHE Reconstructed Human Epidermis. https://www.episkin.com/SkinEthic-RHE (abgerufen am 4.5.2021)
- EpiOcular in vitro 3D Tissues. MatTek Life Sciences
- Epithelix. Products mucilair
- EURL ECVAM. Tracking System for Alternative methods towards Regulatory acceptance (TSAR)
- ECHA. The use of alternatives to testing on animals for REACH. 4.11.2020
- Franzen N. et al. Impact of organ-on-a-chip technology on pharmaceutical R&D costs. ScienceDirect 2019; 24(9)
- Ärzte gegen Tierversuche e.V. Förderung von Tierversuchen und tierversuchsfreier Forschung. 3.5.2021
- Cook D. et al. Lessons learned from the fate of AstraZeneca’s drug pipeline: a five-dimensional framework. Nat Rev Drug Discov 2014; 13(6):419–31
- Arrowsmith J. A decade of change. Nat Rev Drug Discov 2012; 11(17-8)
- Waring M.J. et al. An analysis of the attrition of drug candidates from four major pharmaceutical companies. Nat Rev Drug Discov. 2015; 14(7):475–86
- Harrison R.K. Phase II and phase III failures: 2013–2015. Nat Rev Drug Discov 2016;15(817-8)
- Franzen N. et al. Impact of organ-on-a-chip technology on pharmaceutical R&D costs. Drug Discovery Today 2019; 24(9):1720–4