Herz aus Stein 2020
Wem gebührt das „Herz aus Stein 2020“?
Abstimmung über den schlimmsten Tierversuch des Jahres
Natürlich sind alle Tierversuche schlimm und alle Tierlabore haben diesen Negativpreis verdient! Das „Herz aus Stein“ steht für eine herzlose Forschung, bei der fühlende Lebewesen zu bloßen Messinstrumenten degradiert werden. Mit einer öffentlichen Online-Abstimmung wollen wir auf einige besonders absurde und grausame Tierversuche aufmerksam machen, die in Deutschland durchgeführt worden sind. Nominiert sind Einrichtungen aus Dresden, Halle/Saale, Essen, Homburg/Saar und Tübingen.
Die Auswahl beruht auf Einträgen in unserer Tierversuchs-Datenbank und diese basieren auf Fachartikeln der Experimentatoren selbst. Für den Preis 2020 haben Publikationen ausgewählt, die 2019 veröffentlicht wurden.
Die Online-Abstimmung fand Ende September 2020 statt. Das Ergebnis:
Homburg 2.230
Tübingen 2.191
Halle 1.830
Dresden 669
Essen 381
________________________
gesamt 7.301 Stimmen
Der „Gewinner“
Zwar sehr knapp, aber das Herz aus Stein geht an das Universitätsklinikum des Saarlandes in Homburg/Saar.

Weitere Infos zur Verleihung
Pressemitteilung 02.10.2020 - „Herz aus Stein“ für den schlimmsten Tierversuch geht ans Universitätsklinikum des Saarlandes >>
Pressemitteilung 07.10.2020 - Preis für den schlimmsten Tierversuch verliehen >>
Stellungnahme zu Rückenhautkammern - Eine schwere Last zu tragen >>
Die Kandidaten
| Ort | Ganz kurz | Kurzbeschreibung | Hintergrund | |
|
1 |
Klinik und Poliklinik für Neurochirurgie, Universitätsklinikum Carl Gustav Carus, TU Dresden, Fetscherstraße 74, 01307 Dresden |
|
Axolotl wird der Ischiasnerv durchschnitten und das Nachwachsen wird beobachtet. mehr >> |
Um die Heilungsprozesse nach Nervenverletzungen bei Patienten besser verstehen zu können, werden der Ischiasnerv von Axolotl (mexikanische Schwanzlurche) durchgeschnitten und das Nachwachsen analysiert. |
|
2 |
Julius-Bernstein-Institut für Physiologie, Medizinische Fakultät der Martin-Luther-Universität Halle-Wittenberg, Magdeburger Str. 6, 06112 Halle/Saale |
|
Ratten werden Tumorzellen unter die Haut der Hinterpfoten gespritzt. Ab einer bestimmten Größe des Tumors werden die Tiere 24 Stunden unter Sauerstoffmangel (8% statt normal 21%) gehalten und dann getötet. mehr >> |
Es soll herausgefunden werden, inwiefern eine Übersäuerung durch Sauerstoffmangel bestimmte Krebszellmarker aktiviert. |
|
3 |
Klinik für Neurologie, Universitätsklinikum Essen, Hufelandstr. 55, 45122 Essen |
|
Mäuse erhalten Futter mit normalem (20%) und geringem (8%) Proteinanteil. Anschließend wird durch Verstopfen einer Hirnarterie mit einem Faden ein Schlaganfall künstlich ausgelöst. Nach 24 Stunden werden die neurologischen Ausfallserscheinungen bei den Mäusen beobachtet. mehr >> |
Aus verschiedenen Bevölkerungsstudien ist bekannt, dass der Konsum von rotem Fleisch ein Gesundheitsrisiko darstellt und unter anderem Schlaganfall begünstigt. Hier wird dies an Mäusen nachgestellt. Tatsächlich tragen Mäuse, die proteinarm ernährt wurden, nach einem künstlich ausgelösten Schlaganfall weniger Hirnschäden davon. |
|
4 |
Universitätsklinikum des Saarlands, Kirrberger Str. 100, 66424 Homburg/Saar |
|
Mäuse werden mit einer sogenannten Rückenhautkammer ausgestattet: zwei Metallrahmen, zwischen die die Rückenhaut der Maus geklemmt wird. In das „Bullauge“ des Rahmens werden kleine Stücke Lungengewebe anderer Mäuse eingepflanzt. mehr >> |
Es wird eine Methode vorgestellt, wie man die Entstehung von kleinen Blutgefäßen in Lungengewebe im lebenden Tier beobachten kann. Dazu werden kleine Lungenstücke in eine „Rückenhautkammer“ von Mäusen verpflanzt. Als Vergleich dienen Gebärmuttergewebestücke von Mäusen. |
|
5 |
Institut für Medizinische Genetik und angewandte Genomik, Universität Tübingen, Calwerstraße 7, 72076 Tübingen |
|
Mäuse werden 8 Wochen lang ohne Pause 7 Arten von Stress ausgesetzt: 1 Stunde in enger Röhre, 2 Stunden Käfig in Schieflage, 30 Minuten Konfrontation mit einer Ratte, 16 Stunden Wasserentzug, 16 Stunden Futterentzug, nachts 12 Stunden Licht, vertauschter Tag-Nacht-Rhythmus mehr >> |
Aus Beobachtungen an Parkinson-Patienten weiß man, dass Stress zu einer Verschlimmerung der Symptome bei dieser Erkrankung führen kann. Hier werden Mäuse starkem Leiden ausgesetzt, um dieses bereits bekannte Phänomen an ihnen nachzustellen und die Mechanismen im Gehirn zu untersuchen. |
Die Bilder sind Symbolfotos
Die Details
Kandidat 1

Institut: Klinik und Poliklinik für Neurochirurgie, Universitätsklinikum Carl Gustav Carus, TU Dresden, Fetscherstraße 74, 01307 Dresden
Tiere: 78 Axolotl
Versuch: Axolotl sind mexikanische Schwanzlurche (Salamander), die die Fähigkeit haben, verletzte Organe und sogar Gliedmaßen sehr schnell nachwachsen zu lassen. Die Tiere werden mittels eines Betäubungsmittels, das im Wasser aufgelöst wird, betäubt. An einem Hinterbein jeden Tieres wird der Hüftnerv (Ischiasnerv) durchgeschnitten. Die Wunde wird chirurgisch verschlossen. Bei einigen Tieren wird der gleiche Eingriff nach 7 Tagen wiederholt. Die Axolotl müssen in einem Aquarium gegen eine Wasserströmung schwimmen, um den Bewegungsgrad des verletzten Beins beobachten zu können.
Zwei Tiere werden je 7 und 14 Tage nach der ursprünglichen Verletzung betäubt. Erneut wird ein Schnitt an ihrem Hinterbein gemacht, die Tiere werden mit feuchten Papiertüchern bedeckt, unter ein Mikroskop gelegt und ihre Nerven werden fotografiert. Die Tiere werden in Gruppen an einem von neun verschiedenen Zeitpunkten (0 bis 128 Tage nach der Verletzung) auf nicht genannte Weise getötet und ihre Beine zur weiteren Analyse entnommen.
Hintergrund: Um die Heilungsprozesse nach Nervenverletzungen bei Patienten besser zu verstehen, werden die Hüftnerven von Axolotl (mexikanische Schwanzlurche) durchgeschnitten und das Nachwachsen analysiert.
Quelle: Uckermann O et al. Label-free imaging of tissue architecture during axolotl peripheral nerve regeneration in comparison to functional recovery. Scientific Reports 2019; 9(1): 12641
Kandidat 2

Institut: Julius-Bernstein-Institut für Physiologie, Medizinische Fakultät der Martin-Luther-Universität Halle-Wittenberg, Magdeburger Str. 6, 06112 Halle/Saale
Tiere: mindestens 11 Ratten
Versuch: Zwei Gruppen von Ratten werden 2 verschiedene Tumorzellarten in die Hinterpfoten gespritzt. Diese Tumorzellen wachsen an dieser Stelle zu oberflächlichen Tumoren, die die Unterhaut und die obere Hautschicht verdrängen. Erreichen die Tumore eine Größe von ca. 1,5 Milliliter Volumen, soll der pH-Wert des Tumors und des umliegenden Gewebes gesenkt werden.
Bei einer Gruppe von Ratten wird der pH-Wert gesenkt, indem in das Tumorgewebe Milchsäure gespritzt wird. Die andere Gruppe Ratten erhält eine Substanz in die Bauchhöhle gespritzt, die den Zuckerstoffwechsel beeinflusst, und sie wird in einer Umgebung mit nur 8% Sauerstoffanteil (statt normal 21%) gehalten, d.h. die Tiere leiden massiv an Atemnot. Dies führt ebenfalls dazu, dass der pH-Wert im Gewebe sinkt. Eine Kontrollgruppe Ratten wird bei normalem Sauerstoffgehalt gehalten. Nach 24 Stunden werden die Ratten auf nicht näher beschriebene Weise getötet, das Tumorgewebe wird herausgeschnitten und auf spezielle Tumormarker untersucht.
Hintergrund: Es soll herausgefunden werden, inwiefern eine Übersäuerung bestimmte Krebszellmarker aktiviert.
Quelle: Riemann A et al. Extracellular acidosis modulates the expression of epithelial-mesenchymal transition (EMT) markers and adhesion of epithelial and tumor cells. Neoplasia 2019; 21 (5): 450-458
Kandidat 3

Institut: Klinik für Neurologie, Universitätsklinikum Essen, Hufelandstr. 55, 45122 Essen
Tiere: 36 Mäuse
Versuch: Die Mäuse werden während des ganzen Experiments einzeln gehalten. Die Tiere werden in zwei Gruppen eingeteilt: eine erhält normales Futter mit 20% Proteinanteil und eine Gruppe Futter mit nur 8% Proteinanteil. Nach 7, 14 und 30 Tagen werden jeweils 6 Mäuse aus jeder Gruppe einer Operation unterzogen. Dabei wird unter Narkose der Hals aufgeschnitten, die linke Halsarterie wird abgeklemmt. Durch einen kleinen Schnitt in der Halsarterie wird ein Nylonfaden gefädelt und bis ins Gehirn vorgeschoben, wo er eine Hirnarterie verstopft, sodass der Gewebebereich dahinter nicht mehr durchblutet wird. Auf diese Weise wird ein Schlaganfall simuliert. Mit einem Laser-Doppler-Gerät, das auf dem Kopf aufgesetzt wird, wird überprüft, ob das Blutgefäß tatsächlich verschlossen ist. Nach 30 Minuten wird der Faden wieder herausgezogen und die Wunden werden chirurgisch verschlossen.
Die Tiere erwachen aus der Narkose. 24 Stunden nach der Operation werden die neurologischen Ausfallserscheinungen z.B. anhand der Körperhaltung beurteilt. Es werden keine näheren Angaben dazu gemacht und auf eine ältere Arbeit verwiesen, in der sich aber auch keine Angaben finden. Anschließend wird durch einen Stich ins Herz eine Blutprobe genommen – nicht erwähnt, aber vermutlich in Narkose. Anschließend werden die Mäuse getötet, indem Formalin in die Blutbahn injiziert wird, bis alles Blut ausgetauscht ist. Die Gehirne werden in Scheiben geschnitten und untersucht.
Hintergrund: Aus verschiedenen Bevölkerungsstudien ist bekannt, dass der Konsum von rotem Fleisch ein Gesundheitsrisiko darstellt und unter anderem Schlaganfall begünstigt. Hier wird dies an Mäusen nachgestellt. Tatsächlich tragen Mäuse, die proteinarm ernährt wurden, nach einem künstlich ausgelösten Schlaganfall weniger Hirnschäden davon.
Quelle: Silva de Carvalho T et al. Moderate protein restriction protects against focal cerebral ischemia in mice by mechanisms involving anti-inflammatory and anti-oxidant responses. Molecular Neurobiology 2019; 56: 8477-8488
Kandidat 4
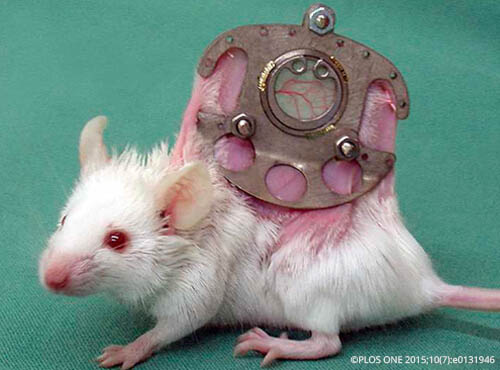
Institut: Universitätsklinikum des Saarlands, Gebäude 41, Kirrberger Str. 100, 66424 Homburg/Saar
Tiere: mindestens 30 Mäuse
Versuch: Die Mäuse werden einzeln gehalten. Den Tieren wird unter Narkose eine sogenannte Rückenhautkammer implantiert. Diese besteht aus zwei Titanplatten mit einem runden Fenster, einer Art Bullauge von 15 mm Durchmesser in der Mitte. Die Rückenhaut der Maus wird geschoren, mehrere Zentimeter hochgezogen und zwischen die beiden mit Schrauben zusammen gehaltenen Titanplatten geklemmt. Auf der einen Seite des Fensters wird die Haut komplett entfernt, so dass im Fenster nun die extrem gespannte Haut einer Seite zu sehen ist, die mit einem Glasplättchen abgedeckt wird. Die Tiere dürfen sich 3 Tage von der Operation erholen. Es wird hervorgehoben, dass die Mäuse die Kammern gut tolerieren und Schlaf und Futteraufnahme nicht beeinträchtigt seien.
Eine nicht genannten Anzahl Mäuse wird getötet, um ihre Lungen zu entnehmen. Diese werden in eine fluoreszierende Flüssigkeit gelegt, damit das Gewebe die Farbe annimmt. Es werden kleine Würfel von einem halben Millimeter Seitenlänge aus den Lungen geschnitten. Jeweils 3-4 Lungenwürfel werden den Mäusen mit den Rückenhautkammern auf die Haut im Bullauge verpflanzt. Bei einigen Mäusen mit Rückenhautkammer wird unter Narkose der Bauch aufgeschnitten, um ein Gebärmutterhorn herauszuschneiden. Dieses wird in fluoreszierende Farbe gelegt und 1-2 kleine Würfel daraus derselben Maus, aus der die Gebärmutter stammt, in das Kammerfenster transplantiert. Unmittelbar danach sowie 3, 6, 10 und 14 Tage nach der Transplantation des Lungen- und Gebärmuttergewebes werden die Tiere betäubt, um das Blutgefäßwachstum der Transplantate im Bullauge unter einem speziellen Mikroskop zu beobachten und zu filmen. Dazu wird den Tieren eine fluoreszierende Flüssigkeit in das Venengeflecht hinter dem Augapfel injiziert. So kann der Blutfluss sichtbar gemacht werden. Nach 14 Tagen werden die Mäuse durch eine Überdosis Betäubungsmittel getötet.
Hintergrund: Es wird eine Methode vorgestellt, wie man die Entstehung von kleinen Blutgefäßen in Lungengewebe im lebenden Tier beobachten kann. Dazu werden kleinen Lungenstücke in eine „Rückenhautkammer“ von Mäusen verpflanzt.
Quelle: Regelin N et al. A murine model to study vasoreactivity and intravascular flow in lung isograft microvessels. Scientific Reports 2019; 9: 5170. doi.org/10.1038/s41598-019-41590-7
(das Foto stammt aus einer anderen Publikation der Universität des Saarlands)
Kandidat 5

Institut: Institut für Medizinische Genetik und angewandte Genomik, Universität Tübingen, Calwerstraße 7, 72076 Tübingen
Tiere: Mindestens 120 Mäuse
Versuch: Die Versuche werden mit Wildtyp-Mäusen (genetisch unverändert) und transgenen Mäusen durchgeführt, bei denen ein menschliches Gen eingebaut wurde. Dieses Gen ist eines von vielen, die bei erblichen Formen von Parkinson im Menschen verändert sind. Von der erblichen Form von Parkinson sind weniger als 10% der Patienten betroffen.
Es werden mehrere Versuche durchgeführt, bei denen die Tiere Stressfaktoren ausgesetzt werden. Bezeichnet wird dies als „chronisches, unvorhersehbares, mildes (!) Stress-Protokoll“. Dieses besteht aus 7 verschiedenen Arten von Stress, denen die Tiere 8 Wochen lang ohne Pause ausgesetzt werden:
Die Stress-Arten sehen folgendermaßen aus:
- Einengung (1 Stunde lang): Hierbei werden die Tiere einzeln in enge Röhrchen gesteckt, in denen sie völlig bewegungsunfähig sind.
- Käfig in Schieflage bringen (2 Stunden lang).
- Direkte Konfrontation mit einer Ratte (30 Minuten lang).
- Wasser-Entzug (16 Stunden lang): Das Wasser wird den Mäusen in der Nacht entzogen. Mäuse sind nachtaktiv, tagsüber schlafen sie die ganze Zeit, daher fehlt ihnen das Wasser in der Aktivitätsphase.
- Futter-Entzug (16 Stunden lang): Auch das Futter wird den Mäusen nachts, also in der aktiven Phase, entzogen. Mäuse reagieren viel empfindlicher auf Futterentzug als Menschen, denn sie nehmen von Natur aus in der aktiven Phase ständig Futter zu sich. Junge Mäuse können beispielsweise nach 12-24 Stunden Futterentzug bereits sterben.
- Licht-Stress (12 Stunden lang nachts).
- Vertauschter Tag-Nacht-Zyklus (das ganze Wochenende über): Tagsüber, wenn die Mäuse schlafen, werden sie der Dunkelheit ausgesetzt, nachts, wenn die Tiere aktiv sind, der Helligkeit. Die Mäuse kommen so kaum zur Ruhe.
Nach 3 und 56 Tagen Stress werden jeweils einige Mäuse durch Genickbruch getötet und der Kopf wird abgeschnitten, um Blut zu gewinnen. Mit anderen Stress ausgesetzten Mäusen werden im Alter von 6 Monaten Verhaltenstests, z.B. zum Angstverhalten durchgeführt. So wird eine Maus in eine Box mit einer hellerleuchteten und einer dunklen Hälfte gesetzt. Es wird beobachtet, wie lange sich die Maus im dunklen Bereich aufhält, was als ängstliches Verhalten gilt. In der Publikation wird erwähnt, dass einige Tiere während des Versuchszeitraums gestorben sind. Es wird nicht gesagt, warum bzw. woran die Tiere verstorben sind, oder ob und aus welchen Gründen sie getötet wurden.
Hintergrund: Aus Beobachtungen an Parkinson-Patienten weiß man, dass Stress zu einer Verschlimmerung der Symptome bei dieser Erkrankung führen kann. Mäuse werden starkem Leiden ausgesetzt, um dieses bereits bekannte Phänomen an ihnen nachzustellen und um die Mechanismen im Gehirn zu untersuchen.
Quelle: Wassouf Z. et al. Distinct stress response and altered striatal transcriptome in alpha-synuclein overexpressing mice. Frontiers in Neuroscience 2019; 12: 1033. Doi: 10.3389/fnins.2018.01033

