Parkinson – Tierversuche und tierversuchsfreie Forschung
Morbus Parkinson ist eine chronisch fortschreitende neurodegenerative Erkrankung. Sie führt zu typischen motorischen Symptomen wie einer Versteifung der Muskeln, verlangsamten Bewegungen und unkontrollierbarem Zittern. Weitere Symptome sind Schlafstörungen, Verlust des Geruchssinns und kognitive Störungen. Bis heute kann Parkinson nicht geheilt werden. Die verfügbaren Medikamente mildern lediglich die Symptome und bremsen das Fortschreiten der Erkrankung bestenfalls ab. Trotz intensiver - überwiegend tierexperimenteller - Forschung wurden in den letzten 40 Jahren keine wesentlichen Verbesserungen der Therapie erreicht und Millionen Erkrankte und ihre Angehörigen warten vergeblich auf Hilfe. Hier können moderne tierversuchsfreie Forschungsverfahren für den Menschen relevante Ergebnisse erzielen, so dass die menschliche Erkrankung endlich verstanden und so eine wirksame Therapie entwickelt werden kann.
Die Erkrankung
Ungefähr 1 % der Bevölkerung über 60 Jahren ist an Parkinson erkrankt (1). Weltweit sind das ca. 6,2 Millionen Menschen und es wird geschätzt, dass diese Zahl bis 2040 auf über 12 Millionen steigt (2).
Die Symptome beruhen darauf, dass im Mittelhirn der Patienten in der sogenannten schwarzen Substanz (Substantia nigra) Zellen zugrunde gehen. Dabei handelt es sich um Nervenzellen, die Dopamin bilden - einen Botenstoff, mit dem Nervenzellen miteinander kommunizieren. Mit zunehmendem Absterben der Dopamin-produzierenden Zellen kommt es zu einem Dopaminmangel, welcher zu den typischen motorischen Symptomen der Erkrankung führt (3). In den Nervenzellen von Parkinson-Patienten werden Ablagerungen gefunden, die das Protein α-Synuclein enthalten und als Lewy-Körperchen bezeichnet werden.
Obwohl die Erkrankung bereits vor über 200 Jahren erstmals beschrieben wurde (1), sind ihre Ursachen noch immer ungeklärt. Es wird vermutet, dass mehrere Faktoren beteiligt sind. In ca. 10 % der Fälle ist die Erkrankung auf genetische Gründe zurückzuführen. Daneben wird insbesondere die Exposition mit Neurotoxinen mit der Entstehung von Parkinson in Verbindung gebracht. Auch Schädel-Hirn-Traumata erhöhen das Risiko für die Erkrankung.
Die Behandlung
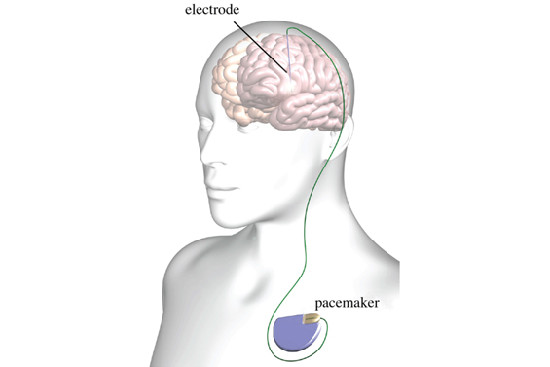
Viele der Medikamente zielen darauf ab, die Dopamin-Konzentration im Gehirn zu erhöhen oder wirken auf die Dopamin-Rezeptoren, um so das Gleichgewicht der Neurotransmitter wiederherzustellen. Die Standardtherapie erfolgt mit der Dopamin-Vorstufe Levodopa. Die Wirksamkeit der Therapie lässt jedoch mit der Zeit nach. Zudem kommt es bei nahezu 50 % der behandelten Patienten innerhalb von 5 Jahren zu schweren Nebenwirkungen wie Bewegungsstörungen und Psychosen; mit längerer Behandlungsdauer steigt der Anteil der von Nebenwirkungen betroffenen Patienten sogar noch weiter an (1). Für Patienten, bei denen die Medikamente nicht zu den gewünschten Verbesserungen der Symptome führen, besteht die Möglichkeit einen sogenannten Gehirnschrittmacher zu implantieren. Dieser stimuliert über dauerhaft in das Gehirn eingebrachte Elektroden die Nervenzellen (4). Diese Tiefenhirnstimulation führt dazu, dass die meisten Patienten ihre Medikamentendosis und somit die dadurch verursachten Nebenwirkungen verringern können. Eine Heilung ermöglicht auch die Tiefenhirnstimulation nicht, zudem wirkt sie nicht bei allen Erkrankten (1).
Neuere Studien untersuchten die Einsetzbarkeit von Stammzelltransplantationen, diese brachten jedoch lediglich für jüngere Patienten einen Nutzen und verursachten schwere Nebenwirkungen und der erzielte „Erfolg“ war zudem nur von zeitlich begrenzter Dauer (5). Auch Gentherapien werden zur Behandlung von Parkinson untersucht, zeigen jedoch nur eine geringe Effektivität (1).
Die Erkrankung und ihre Ursachen sind noch immer nicht verstanden und die Wirksamkeit der verfügbaren Medikamente und Behandlungsmethoden, welche mit erheblichen Nebenwirkungen verbunden sind, ist begrenzt. Somit besteht nach wie vor erheblicher Forschungsbedarf.
Tierversuche in der Parkinsonforschung
Die tierexperimentell ausgerichtete Parkinsonforschung verwendet sogenannte Tiermodelle, bei welchen bei Tieren künstlich an Parkinson erinnernde Symptome oder Veränderungen hervorgerufen werden. Die Parkinson-ähnlichen Symptome werden auf verschiedene Weise hervorgerufen, zum Beispiel indem Medikamente oder Toxine (Gifte) verabreicht oder in das Gehirn der Tiere gespritzt werden (6). Nachdem ein solches „Tiermodell“ „hergestellt“ worden ist, wird durch Bewegungs- und/oder Verhaltenstest der Erfolg der Manipulation überprüft. Dann wird bei den Tieren eine potenzielle Therapie durchgeführt und die Tests werden wiederholt, um so festzustellen, ob eine Besserung der künstlich herbeigeführten Symptome eintritt.
Medikamenten-induzierte Modelle
In den 1950er Jahren wurde beobachtet, dass die psychiatrischen Wirkstoffe Resperin und Haloperidol an Parkinson erinnernde motorische Symptome hervorrufen können (7). Dies stellte die Basis zur Entwicklung der ersten sogenannten Tiermodelle für Parkinson dar. Der Wirkstoff Resperin blockiert ein für den Dopamintransport zuständiges Membranprotein und führt so zu einer Verringerung der Dopamin-Konzentration. Allerdings wird nicht nur die Konzentration von Dopamin verringert, sondern auch die anderer Monoamine, wie Serotonin und Noradrenalin, welche bei Parkinson nicht betroffen sind (6). Zudem ist der Effekt nicht von Dauer (1). Resperin wird den Tieren - üblicherweise Mäusen aber auch anderen Tieren - gespritzt. Häufig wird der Wirkstoff wiederholt gespritzt, um so trotz der begrenzten Wirkdauer ein Voranschreiten der Erkrankung nachzuahmen. In einem anderen „Tiermodell“ wird Haloperidol verwendet. Dies bewirkt eine vorübergehende Katalepsie der Tiere, das ist ein Zustand des Verharrens in einer starren Körperhaltung (6). Die pharmakologischen Modelle sind einfach „herzustellen“, bilden jedoch nur Teilaspekte der Erkrankung nach.
Toxin-induzierte Modelle
In den 80er Jahren wurde zufällig entdeckt, dass das Toxin 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP) nach Injektion eines verunreinigten Heroinersatzstoffes zu Parkinson-ähnlichen Symptomen führt. Das lipophile MPTP ist in der Lage, die Blut-Hirnschranke zu überwinden und verursacht im Gehirn das Absterben von Dopamin-produzierenden Zellen (8). MPTP führt dabei zu oxidativem Stress und einer mitochondrialen Dysfunktion, welche zu einer Entzündung und Degeneration der Dopamin-erzeugenden Neuronen in der schwarzen Substanz und so zu motorischen Störungen führen. Weitere Toxine, die genutzt werden, um Parkinson-ähnliche Symptome in Tieren zu erzeugen sind Pestizide wie Rotenon, Paraquat und Permethrin sowie aus Bakterien stammende Endotoxine. Während MPTP und die Pestizide systemisch verabreicht werden, werden Endotoxine direkt in das Gehirn gespritzt und führen dort zum Tod der Nervenzellen.
Toxin-Modelle führen zum schnellen Absterben der Dopamin-bildenden Nervenzellen und führen so zu an Parkinson erinnernde Bewegungsstörungen (6). Allerdings handelt es sich dabei um einen akuten Prozess und nicht um eine allmählich fortschreitende chronische neurodegenerative Erkrankung. Viele Aspekte der Erkrankung des Menschen werden nicht nachgebildet, es kommt unter anderem nicht zur Bildung der α-Synuclein Ablagerungen, die für Parkinson als typisch angesehen werden (1).
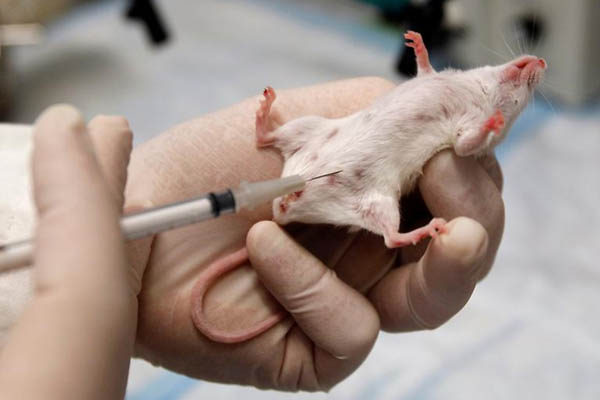
Abbildung 1: Mäusen werden Giftstoffe verabreicht, die Nervenzellen schädigen und so zu an Parkinson erinnernden Symptomen führen.
Genetische Modelle
Ungefähr 10 % der Parkinson-Erkrankungen sind genetisch bedingt. Mit der Entdeckung verschiedener Formen der familiären, also erblichen Parkinsonerkrankung, begannen die Versuche in „Tiermodellen“ die Erkrankung durch Gentechnik nachzubilden. Dafür werden bestimmte Gene der Tiere - hier werden vor allem Mäuse eingesetzt - ausgeschaltet oder mit der Erkrankung in Verbindung stehende menschliche Gene werden in das Genom der Tiere eingebaut.
Eine Form der familiären Parkinson-Erkrankung zeichnet sich durch eine Verdopplung oder Verdreifachung des α-Synuclein kodierenden Gens aus. Dies führt zu einer Erhöhung der α-Synuclein-Expression und einer Bildung von Lewy- Körperchen, welche bei Patienten in der Schwarzen Substanz aber auch in anderen Gehirnregionen gefunden werden. Daneben gibt es eine ganze Reihe von Genmutationen, die bei familiär bedingtem Parkinson vorkommen und die zur Entwicklung von „Tiermodellen“ genutzt werden (9)(1). Auch wenn in Tieren bei Menschen vorkommende und mit Parkinson assoziierte Mutationen verursacht werden, bilden sie nicht das Krankheitsbild Parkinson aus. So fehlt bei fast allen dieser Tiermodelle der typische Verlust an Dopamin-erzeugenden Neuronen, was wesentlicher Bestandteil der menschlichen Erkrankung ist (9).
α-Synuclein-Modelle
Wie im letzten Abschnitt beschrieben, kann die genetisch bedingte Überexpression von α-Synuclein zur Herstellung sogenannter Tiermodelle genutzt werden. Daneben gibt es weitere „Tiermodelle“, die versuchen, durch Erhöhung der α-Synuclein-Konzentration Parkinson-ähnliche Zustände bei Tieren hervorzurufen: Das Protein wird direkt in das Gehirn der Tiere gespritzt oder virale Vektoren werden genutzt, um die Herstellung des Proteins vor Ort, also direkt im Gehirn der Tiere, zu bewirken (6,9). Manche der auf α-Synuclein beruhenden „Tiermodelle“ zeigen Verhaltensänderungen, einige weisen eine Verringerung der Dopamin-Konzentration auf. Allerdings führt die Manipulation in den meisten Fällen nicht zu einem Absterben der Dopamin-produzierenden Neuronen, so dass der Zustand der Tiere nicht mit Parkinson vergleichbar ist.
Derzeitiger Stand der tierexperimentellen Parkinsonforschung
Keines der genannten Modelle ist in der Lage, die komplexe menschliche Erkrankung nachzubilden. So müssen die Modelle vermeintlich immer weiter optimiert werden, in dem Glauben, dass sie sich dadurch der menschlichen Erkrankung annähern lassen. Daneben bleibt es den tierexperimentell Forschenden nur, einzelne Teilaspekte der Erkrankung in verschiedenen „Tiermodellen“ zu untersuchen (6) und verschiedene Modelle miteinander zu kombinieren (9). Angesichts der generell schlechten Übertragbarkeit der Ergebnisse aus dem Tiermodell (10) auf den Menschen erscheint dieses Konzept – verschiedene Teilaspekte einer nicht verstandenen Erkrankung in verschiedenen Tiermodellen, deren Übertragbarkeit auf den Menschen nicht gegeben ist, zu untersuchen – nicht aussichtsreich.
Tierversuche in der deutschen Parkinsonforschung
Die vom Bundesinstitut für Risikobewertung gemeldeten Zahlen über die Verwendung von Versuchstieren in Deutschland geben die für die Parkinsonforschung verwendeten Versuchstiere nicht explizit an. Vielmehr sind die Zahlen in den Kategorien Grundlagenforschung zum Thema „Nervensystem“, der angewandten Forschung zu „Nerven- und Geisteserkrankungen des Menschen“, sowie der „Verwendungen zu regulatorischen Zwecken“ verborgen, in denen neben Parkinson jedoch auch weitere Erkrankungen zusammengefasst sind. Hinzu kommen noch weitere Tiere die zur Herstellung und dem Erhalt von gentechnisch veränderten Linien – die gerade in der Parkinsonforschung häufig eingesetzt werden – sowie die sogenannten Überschusstiere, die für die Parkinsonforschung gezüchtet aber nicht verwendet wurden.
Um dennoch einen Eindruck von der Größenordnung des „Tierverbrauchs“ der Parkinsonforschung in Deutschland zu gewinnen, kann die Datenbank AnimalTestInfo herangezogen werden, in der die sogenannten nichttechnischen Projektzusammenfassungen (NTPs) von in Deutschland genehmigten Tierversuchen veröffentlicht werden (11). Dies führt zwar nicht zu dem exakten jährlichen „Verbrauch“ an Tieren, da die NTPs beispielsweise im Bereich der Grundlagenforschung häufig schwammige Begründungen enthalten und beispielsweise nicht ausschließlich die Erforschung von Parkinson, sondern auch anderen neurodegenerativen Erkrankungen wie Alzheimer gleichzeitig als Zweck der Versuche angegeben. Dennoch ermöglicht diese Vorgehensweise eine Annäherung an die Zahl und Art der Versuchstiere, die in Deutschland im Namen der Parkinsonforschung leiden.
Eine Recherche in AnimalTestInfo mit der Stichwortsuche „Parkinson“ für das Jahr 2022 ergibt 61 Tierversuchsvorhaben. Insgesamt wurde dabei die Verwendung von 106.465 Tieren genehmigt. Davon waren über 95 % Mäuse. Somit ist die Maus in der Parkinsonforschung Hauptleidtragende; sie wurde daher auch 2019 vom Bundesverband Menschen für Tierrechte zum Versuchstier des Jahres gewählt (12). Neben Mäusen sind es vor allem Ratten, die in der Parkinsonforschung eingesetzt werden. Aber auch Zebrafische werden verwendet in der Hoffnung, dass die Regenerationsfähigkeit ihres Gehirns Hinweise für mögliche Therapien von Parkinson und anderen neurodegenerativen Erkrankungen geben könnte. Zudem wurde die Verwendung von 47 Javaneraffen für regulatorische Zwecke genehmigt. Diesen Tieren werden in der Entwicklung befindliche Wirkstoffe oder Gentherapeutika verabreicht oder in das Gehirn gespritzt, um daraus Informationen zur Toxizität und Pharmakologie der Substanzen abzuleiten.
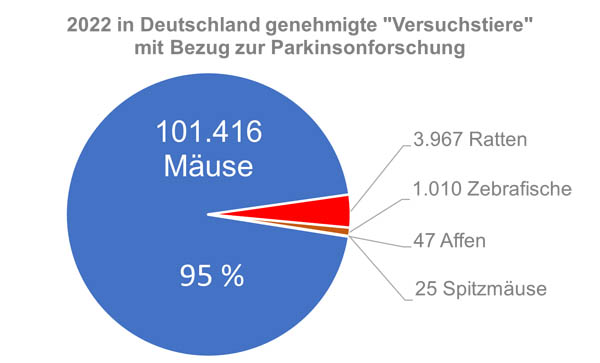
Abbildung 2: Abschätzung des Tierverbrauchs der deutschen Parkinson-Forschung.
Warum Tierversuche scheitern
Seit 60 Jahren werden immer neue Tiermodelle für die Parkinsonforschung entwickelt (1). Trotz all dieser Tiermodelle gibt es seit den 1950er Jahren keinen wesentlichen Fortschritt in der Entwicklung von Therapeutika, die bisher ausschließlich die Symptome lindern und nicht auf die – nach wie vor unbekannten – Ursachen der Erkrankung abzielen (1).
Keines der Tiermodelle kann Parkinson tatsächlich simulieren, jedes Modell bildet nur einzelne Aspekte der Erkrankung nach. Parkinson zeichnet sich vor allem durch ein schleichendes Zugrundegehen von Nervenzellen aus. Sehr viele „Tiermodelle“ in der Parkinsonforschung dagegen werden durch eine einmalige, hochdosierte Injektion eines Giftes „hergestellt“. So verwundert es nicht, dass zwar 90 % der Studien bei Mäusen, 95 % der Studien bei Ratten und 67 – 80 % der Studien bei Affen erfolgreich verliefen, aber nur 32 % der auf den tierexperimentellen präklinischen Studien fußenden klinischen Studien beim Menschen klinische Verbesserungen brachten (10,13).
Und so resümiert auch Prof. Bernhard Hiebl von der Tiermedizinischen Hochschule Hannover zur Aussagekraft von Tierversuchen für Parkinson und andere neurodegenerative Erkrankungen: „Für sie existieren über 50 erfolglose klinische Studien am Menschen mit Wirkstoffen, die allesamt zuvor im Tiermodell erfolgreich waren (14)“.
Dennoch wird von Tierversuchsbefürwortern noch immer behauptet, dass die sogenannten Tiermodelle für die Erfolge in der Parkinsonforschung entscheidend gewesen seien. Beispielsweise wäre das MPTP-Modell zur Entwicklung der Tiefenhirnstimulation ausschlaggebend gewesen. Tatsächlich wurde die Methode jedoch - bereits Jahrzehnte bevor MPTP an Affen verabreicht wurde – durch Untersuchungen am Menschen erforscht und entwickelt (4).
Tierversuchsfreie Parkinsonforschung
Aufgrund der enormen Schwächen der sogenannten Tiermodelle werden dringend bessere und vor allem humanrelevante Modelle benötigt, um die Erkrankung endlich zu verstehen und so mögliche Therapien entwickeln zu können. Diese sollten sich direkt auf den Menschen oder sogar den einzelnen Patienten fokussieren.
Menschliche und Patienten-eigene Zellen
Da es schwierig ist, an primäre menschliche Neuronen zu gelangen und diese auch schwierig in Kultur zu halten sind, werden in der Parkinsonforschung häufig immortalisierte menschliche Zelllinien verwendet. Dabei wird zum Beispiel die menschliche Neuroblastom-Zelllinie SH-SY5Y eingesetzt (1). Auch wenn die Forschung an diesen Zellen beispielsweise dazu beigetragen hat, funktionelle Studien einiger an Parkinson beteiligten Gene durzuführen, unterscheiden sich die Zellen aufgrund ihrer Herkunft aus einem Tumor deutlich von gesunden Nervenzellen.
Stammzellen können in Dopamin-produzierende Nervenzellen differenziert werden. Dabei ist man heute nicht mehr auf embryonale Stammzellen angewiesen, sondern kann bspw. Hautzellen in sogenannte induzierte pluripotente Stammzellen (iPSCs) umwandeln, welche in der Lage sind, sich in die verschiedensten Zelltypen wie beispielsweise Dopamin-erzeugende Neuronen zu differenzieren. Dabei können patienteneigene Zellen eingesetzt werden, die dann für den jeweiligen Patienten charakteristische Veränderungen enthalten. So weisen Neuronen, die aus iPSCs von Patienten mit einer Verdreifachung des α-Synuclein kodierenden Gens gewonnen wurden, erhöhte Konzentrationen des Proteins auf (1). Neben einem besseren Verständnis der Erkrankung bietet sich der Einsatz insbesondere bei der Entwicklung neuer Wirkstoffe an. Dabei können viele verschiedene Wirkstoffe parallel an den Zellen verschiedener Patienten getestet werden, so dass Medikamente gegen unterschiedliche Formen von Parkinson effektiv gefunden werden können.
Zellkulturen lassen sich mit mikrofluidischen Systemen kombinieren, welche die Möglichkeit bieten, die Umgebung der untersuchten Zellen genau zu kontrollieren. So ist es möglich, beispielsweise Konzentrations-Gradienten in einer Mikrofluidik einzustellen und so die dosisabhängigen Effekte von Substanzen auf Neuronen zu untersuchen (15).
Organoid-basierte Modelle
Organoide spiegeln die Komplexität des menschlichen Gewebes besser wider als herkömmliche zweidimensionale Zellkulturen und gerade im Kontext des Gehirns, in dem die Neuronen miteinander vernetzt sind, bietet sich der Einsatz von dreidimensionalen Zellkulturmodellen an. Aus patienteneigenen Zellen lassen sich Gehirn-Organoide entwickeln, die Dopamin-erzeugende Neuronen beinhalten und die genetischen Veränderungen des jeweiligen Patienten tragen. An solchen Organoiden lassen sich die Grundlagen und Mechanismen der Erkrankung direkt an menschlichem Material untersuchen (16). Durch Kombination mit der sogenannten Genschere CRISP/CAS, mit der gezielt veränderte Gene eingefügt oder auch schadhafte Gene repariert werden können, lässt sich der Einfluss von verschiedenen Mutationen untersuchen. Neben den genetisch bedingten Parkinson-Erkrankungen lassen sich auch Umweltfaktoren an Organoiden untersuchen (17).
Aus menschlichen Hirnzellen gezüchtete Organoide, spiegeln - wenn sie aus Zellen von Patienten hergestellt werden - deren individuelle Erkrankung wider. Außerdem bieten sie die Möglichkeit zur Testung verschiedener Therapieformen (18).
Parkinson-on-a- Chip-Modelle
Die Kombination von Dopamin-erzeugenden Neuronen mit anderen Gehirnzellen und Endothelzellen der Blutgefäße auf einem sogenannten Organchip ermöglicht es, Parkinson auf einem Chip nachzuahmen. Dabei kann auch die Blut-Hirn-Schranke nachgebildet werden, welche durch Wirkstoffe überwunden werden muss. Auf solchen Organchips ist es möglich, verschiedene Aspekte der Erkrankung nachzubilden. So konnte die Ablagerung von α-Synuclein, die Schädigung der Mitochondrien sowie die Entzündung der Nervenzellen und die Schädigung der Blut-Hirn-Schranke auf einem Chip beobachtet und untersucht werden (19). Diese Systeme ermöglichen die Einbeziehung von Zell-Zell-Interaktionen und der zellulären Umgebung und können ebenso für die Testung neuer Wirkstoffe verwendet werden wie für die Untersuchung der Krankheitsentstehung (20).
In-silico-Modelle
Computersimulationen, mathematische Algorithmen und künstliche Intelligenz ermöglichen die Aufklärung molekularer Wechselwirkungen. Dies kann sowohl zur Vorhersage der Wirksamkeit als auch der Nebenwirkungen einer Substanz beitragen (1). Diese Methoden stellen eine wertvolle Möglichkeit zur zielgerichteten Entwicklung neuer Wirkstoffe dar, da sie direkt auf den molekularen Grundlagen der Erkrankung beruhen (21).
Epidemiologische Studien
Parkinson ist keine einheitliche Erkrankung, vielmehr unterscheiden sich die Verläufe der Patienten stark (22). Viele relevante Informationen können durch Bevölkerungs- oder Patientenstudien erlangt werden. So zum Beispiel auch bei der 1990 begonnenen Rotterdam-Studie. Hier handelt es sich um eine prospektive epidemiologische Studie, die bisher drei Kohorten von jeweils mehreren Tausend Teilnehmern umfasst. Ziel der Studie ist es, Faktoren zu untersuchen, die das Auftreten von verschiedenen Erkrankungen bei älteren Menschen bestimmen (23). Durch solche epidemiologischen Studien wird man die verschiedenen Formen der Parkinson-Erkrankung besser verstehen und für die unterschiedlichen Untergruppen der Patienten jeweils passende Therapien entwickeln können (10). Auch Untersuchungen von Hirngewebe verstorbener Parkinsonpatienten liefern entscheidende Informationen. So wurde die jahrzehntelange Annahme, dass Proteinablagerungen in den Nervenzellen die Ursache für die Erkrankung sind, widerlegt (24). Dies zeigt deutlich, dass sich die Suche nach den Krankheitsursachen stärker an den Veränderungen beim Menschen orientieren sollte.
Derzeitiger Stand der tierversuchsfreien Parkinsonforschung
Trotz der vielfältigen Entwicklung tierversuchsfreier Forschungsmodelle und ihrer Vorteile fokussiert sich die Parkinsonforschung nach wie vor auf ihre „Tiermodelle“. Eine Analyse der Literatur brachte das niederschmetternde Ergebnis, dass der Anteil der publizierten Forschungsarbeiten, welcher humanrelevante In-vitro-Modelle verwendet, in den letzten 40 Jahren konstant geblieben ist (10).
Hier sind dringend ein Umdenken sowie eine Umverteilung der Fördermittel erforderlich. Dadurch könnte nicht nur das Tierleid verringert werden, sondern vor allem auch die Entwicklungen in der human-relevanten Parkinsonforschung rasant vorangetrieben werden.
Prävention
Auch wenn die genauen Ursachen der Parkinson-Erkrankung in den meisten Fällen noch immer unklar sind, gibt es bestimmte Risikofaktoren, die die Erkrankung begünstigen. Neben dem Alter und der genetischen Veranlagung stellen insbesondere Schadstoffe wie Pestizide einen Risikofaktor dar (6).
Bereits vor 40 Jahren wurde beobachtet, dass das Toxin MPTP zur Zerstörung von Nervenzellen in der schwarzen Substanz und den resultierenden charakteristischen Parkinson Symptomen führt (8). Seitdem wurde festgestellt, dass auch die Exposition mit Pestiziden das Risiko für Parkinson erhöht (6,25). Somit stellt der Umgang mit solchen Schadstoffen sowie die Verschmutzung unserer Umwelt einen entscheidenden Risikofaktor dar. Hier ist vor allem der Gesetzgeber in der Pflicht, die Verbraucher bestmöglich vor solchen Substanzen zu schützen.
Auch bestimmte Medikamente wie Beta-Adrenozeptor-Antagonisten, besser bekannt als Betablocker stehen mit einem erhöhten Risiko einer Parkinsonerkrankung in Verbindung (26). Betablocker werden häufig bei Bluthochdruck verschrieben. Hier sollte geprüft werden, ob sich der Blutdruck nicht auch ohne solche Medikamente durch eine Anpassung des Lebensstils, eine Gewichtsreduktion und eine angepasste, vorzugsweise pflanzliche Ernährung normalisieren lässt.
Die überwiegende Mehrzahl der durchgeführten Bevölkerungsstudien zeigt einen Zusammenhang zwischen dem Risiko an Parkinson zu erkranken und dem Konsum von Milch und Milchprodukten (26). So erhöht der Konsum größerer Mengen Milch das Risiko, an Parkinson zu erkranken im Vergleich zu Personen, die auf Milch verzichten um mehr als den Faktor 2 (27). Der Verzicht auf Milchprodukte kann also deutlich zur Verringerung des persönlichen Risikos beitragen.
Das Rauchen von Zigaretten scheint einen schützenden Effekt vor Parkinson zu haben, welcher auf der Wirkung von Nikotin auf das Zentralnervensystem beruhen könnte. Ebenso wäre es jedoch möglich, dass Personen, die eine Veranlagung für Parkinson haben, weniger zum Rauchen neigen (26). Allerdings haben Raucher ein drastisch erhöhtes Risiko für eine ganze Reihe von schwerwiegenden Erkrankungen, weswegen das Rauchen als möglicher Schutz vor Parkinson keineswegs ratsam ist.
Wenig risikobehaftet ist dagegen der Konsum von Tee oder Kaffee, welcher das Risiko, an Parkinson zu erkranken aufgrund der neuroprotektiven Wirkung von Koffein, Theanin und Flavonoide verringert.
Fazit
Nach wie vor sind die Grundlagen der Parkinson-Erkrankung nicht verstanden. Zudem handelt es sich um eine sehr variable Erkrankung, mit verschiedenen Ursachen und verschiedenen Verläufen, die unterschiedlich auf die vorhandenen Therapien anschlagen. Dennoch konzentriert sich die Parkinsonforschung weiterhin auf sogenannte Tiermodelle, bei denen bei jungen genetisch einheitlichen Tieren einzelne Teilaspekte der komplexen Erkrankung des Menschen erzeugt werden. Wie es überhaupt möglich sein soll, eine Erkrankung, die noch nicht einmal verstanden wurde, bei Tieren, die diese Erkrankung nicht natürlich entwickeln können, zu simulieren, sei dahingestellt. Mit den individuell unterschiedlichen Patienten, die überwiegend in höherem Alter und aus verschiedenen Gründen an Parkinson erkranken, haben diese sogenannten Tiermodelle nichts gemein. So ist es nicht verwunderlich, dass die Parkinsonforschung seit über 40 Jahren auf der Stelle tritt. Mit tierversuchsfreien Methoden wird hingegen direkt an menschlichem Material oder sogar an patientenspezifischen Zellen, welche die individuelle Erkrankung des Patienten widerspiegeln, geforscht. Diese Methoden, die bereits heute einen wesentlichen Beitrag zur Erforschung der Erkrankung leisten, müssen stärker gefördert werden, um so ihr volles Potenzial entfalten zu können. Dies würde den Patienten, die bisher vergebens auf Heilung und verbesserte Therapien warten, berechtigten Grund zur Hoffnung geben.
09.05.2023
Dr. Johanna Walter
Weitere Informationen
Parkinson-Behandlung mit Tiefenhirnstimulation (Hirnschrittmacher)
Der geschichtlich korrekte Weg zur Entdeckung und Entwicklung der Tiefenhirnstimulation
Quellen
- Marshall L.J. et al. Parkinson’s disease research: adopting a more human perspective to accelerate advances. Drug Discovery Today 2018; 23(12):1950–1961
- Feigin V.L. et al. Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology 2019; 18(5):459–480
- Deutschen Gesellschaft für Parkinson und Bewegungsstörungen e.V.: Parkinson hat viele Gesichter.
- Ott C. et al. Parkinson-Behandlung mit Tiefenhirnstimulation (Hirnschrittmacher). 2017
- Freed C.R. et al. Transplantation of Embryonic Dopamine Neurons for Severe Parkinson’s Disease. New England Journal of Medicine 2001; 344(10):710–719
- Lama J. et al. Animal models of Parkinson’s disease: a guide to selecting the optimal model for your research. Neuronal Signaling 2021; 5(4):NS20210026
- Carlsson A. et al. 3,4-Dihydroxyphenylalanine and 5-Hydroxytryptophan as Reserpine Antagonists. Nature 1957; 180(4596):1200–1200
- Langston J.W. et al. Chronic Parkinsonism in Humans Due to a Product of Meperidine-Analog Synthesis. Science 1983; 219(4587):979–980
- Blesa J. et al. Challenges in Parkinson’s Disease, InTech, 2016
- Marshall L.J. et al. Poor Translatability of Biomedical Research Using Animals — A Narrative Review. Alternatives to Laboratory Animals 2023; doi: 10.1177/02611929231157756:026119292311577
- AnimalTestInfo
- Menschen für Tierrechte - Bundesverband der Tierversuchsgegner e.V.: Versuchstier des Jahres 2019: Die Maus in der Parkinson-Forschung
- Zeiss C.J. et al. Established patterns of animal study design undermine translation of disease-modifying therapies for Parkinson’s disease. PLOS ONE 2017; 12(2):e0171790
- Walsweer T.: Tierversuche: Geht’s auch ohne? VolkswagenStiftung 2019
- Seidi A. et al. A microfluidic-based neurotoxin concentration gradient for the generation of an in vitro model of Parkinson’s disease. Biomicrofluidics 2011; 5(2):022214
- Smits L.M. et al. Modeling Parkinson’s disease in midbrain-like organoids. npj Parkinson’s Disease 2019; 5(1):5
- Galet B. et al. Patient-Derived Midbrain Organoids to Explore the Molecular Basis of Parkinson’s Disease. Frontiers in Neurology 2020; 11:1005
- Smits L.M. et al. Midbrain Organoids: A New Tool to Investigate Parkinson’s Disease. Frontiers in Cell and Developmental Biology 2020; 8:359
- Pediaditakis I. et al. Modeling alpha-synuclein pathology in a human brain-chip to assess blood-brain barrier disruption. Nature Communications 2021; 12(1):5907
- Miccoli B. et al. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Current Pharmaceutical Design 2019; 24(45):5419–5436
- Cruz-Vicente P. et al. Recent Developments in New Therapeutic Agents against Alzheimer and Parkinson Diseases: In-Silico Approaches. Molecules 2021; 26(8):2193
- Williams-Gray C.H. et al. The CamPaIGN study of Parkinson’s disease: 10-year outlook in an incident population-based cohort. Journal of Neurology, Neurosurgery & Psychiatry 2013; 84(11):1258–1264
- Ikram M.A. et al. The Rotterdam Study: 2018 update on objectives, design and main results. European Journal of Epidemiology 2017; 32(9):807–850
- Shahmoradian S.H. et al. Lewy pathology in Parkinson’s disease consists of crowded organelles and lipid membranes. Nature Neuroscience 2019; 22(7):1099–1109
- Hatcher J. et al. Parkinson’s disease and pesticides: a toxicological perspective. Trends in Pharmacological Sciences 2008; 29(6):322–329
- Belvisi D. et al. Modifiable risk and protective factors in disease development, progression and clinical subtypes of Parkinson’s disease: What do prospective studies suggest? Neurobiology of Disease 2020; 134:104671
- Park M. et al. Consumption of milk and calcium in midlife and the future risk of Parkinson disease. Neurology 2005; 64(6):1047–1051
