Multiple Sklerose: Tierversuche und tierversuchsfreie Methoden
Multiple Sklerose, MS, Encephalomyelitis disseminata oder G35 – dies alles bezeichnet eine chronisch-entzündliche Erkrankung des zentralen Nervensystems, bei dem die Nervenfasern geschädigt werden. Die Krankheit ist multifaktoriell und die genauen Ursachen sind noch intransparent, was somit auch dazu führt, dass keine Medikamente bisher einen durchschlagenden Therapie-Erfolg gezeigt haben. Ein Stolperstein auf diesem Weg sind die verwendeten „Tiermodelle“. Die einzig verfügbaren zeigen Symptome, die denen der MS nur ähnlich sind und auch nur einen Teil der Stadien der MS reproduzieren. Licht ins Dunkel brachten dagegen vor allem Humanstudien.
In Deutschland leiden ca. 250.000 Menschen an der degenerativen Nervenkrankheit, weltweit sind es ca. 2,8 Millionen (1). Die Krankheit beginnt meist zwischen dem 20. und 40. Lebensjahr, es gibt jedoch auch Fälle, in denen bereits im Kindesalter Symptome auftreten. Frauen sind ungefähr doppelt so häufig betroffen wie Männer. Typische Symptome sind Lähmungserscheinungen und Spastiken vor allem an den Beinen sowie Sehstörungen, ebenso Empfindungsstörungen der Haut, Schluck- und Sprachprobleme; all dies kann mit Schmerzen verbunden sein.
Die Symptome treten oft in Schüben auf, in denen sich ein oder mehrere Symptome über einen Zeitraum von mindestens 24 Stunden bis zu mehreren Wochen zeigen. Diese bilden sich – insbesondere am Anfang häufig - vollständig, manchmal auch nur teilweise wieder zurück (schubförmig remittierende MS = Relapsing-Remitting MS = RRMS). Mit fortschreitender Krankheitslänge erfolgt meist nur eine unvollständige Remission, so dass sich die Symptome oder der Schweregrad der Symptome aufaddieren und somit das Leben der Betroffenen sukzessive einschränken. Der Verlauf zeigt eine schrittweise stetige Verschlechterung mit möglichen Schüben - dies nennt sich sekundär progrediente MS (engl. Secondary Progressive MS = SPMS). Bei ca. 10% der Betroffenen erfolgt von Anfang an eine langsame Verschlechterung des Zustandes ohne klar abzugrenzende Schübe; hier spricht man von primär progredienter MS (engl. Primary Progressive MS = PPMS) (1).
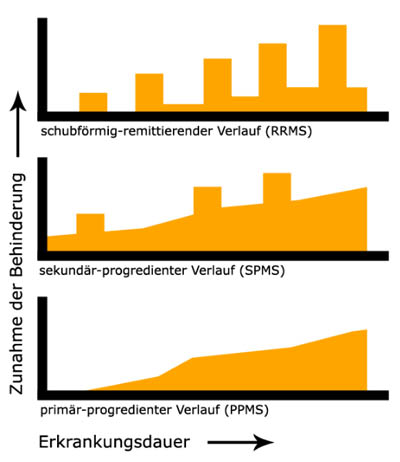
Verlaufsformen der Multiplen Sklerose. Wikipedia
Da die Krankheit so unterschiedliche Symptome und Verläufe zeigt, ist eine Prognose nach Diagnose kaum möglich; im Mittel sind die Hälfte der Betroffenen nach 15 Jahren auf eine Gehhilfe angewiesen, nach 25 Jahren ist ein Drittel nicht mehr gehfähig (2).
Maßgeblich für den Krankheitsmechanismus ist hier die Zerstörung des Myelins, der Isolationsschicht der Axone der Neurone in Gehirn und Rückenmark. Dieses wird (im zentralen Nervensystem) von Oligodendrozyten und (im peripheren Nervensystem) von Schwann-Zellen gebildet. Die sogenannten Myelinscheiden, die die Nervenfortsätze umhüllen, ermöglichen eine schnellere Signalweiterleitung und sind für diese unverzichtbar. Wird die Schicht teilweise oder ganz zerstört, können Nervensignale nur verlangsamt, unzureichend oder gar nicht transportiert werden – die Folge sind eben jene Muskelaktivitäts- und Empfindungseinschränkungen.
Grund für die Zerstörung dieser so wichtigen Substanz ist ein fehlgeleitetes Immunsystem: dieses greift das Myelin der Betroffenen an und schädigt es. Das geschieht an mehreren (>> multiplen) Stellen von Gehirn und Rückenmark, wobei es, insbesondere im Anfangsstadium, zu einer Remyelinisierung kommen kann; manchmal bzw. bei fortschreitender Krankheitsdauer kommt es zu einer Vernarbung (>> Sklerose). Diese Vernarbungen treten auch räumlich gehäuft auf, so dass die Veränderungen ab einer gewissen Größe auch im MRT sichtbar sind (3).
MS ist als Autoimmunkrankheit einzuteilen, wobei die Ursachen, welche das Immunsystem derart triggern, nach wie vor nicht genau bekannt sind. Wahrscheinlich sind diese Ursachen multifaktoriell aus genetischen und Umweltfaktoren und führen dazu, dass eine Lymphozyten-vermittelte autoimmune Entzündungsreaktion sich gegen bestimmte Proteine der körpereigenen Myelinscheiden richtet.
Tierversuche für MS
Die meisten Experimente in diesem Bereich werden mit Mäusen durchgeführt, aber ebenso mit Ratten und Makaken bzw. Weißbüschelaffen. Auch Zebrafische werden in letzter Zeit häufiger verwendet. Insbesondere Affen werden für die sehr leidvollen Giftigkeits-Versuche von potenziellen Medikamentenkandidaten benutzt (4).
Einige Beispiele:
Die für ein Experiment verwendeten 70 männlichen und weiblichen Mäuse gehören einer Inzuchtlinie an, die besonders anfällig für eine geschlechtsabhängige experimentelle autoimmune Enzephalomyelitis (EAE) sind. Dabei handelt es sich um eine künstlich herbeigeführte entzündliche Erkrankung des zentralen Nervensystems, die als „Modell“ in der Multiplen Sklerose-Forschung eingesetzt wird. Um bei den Mäusen die EAE auszulösen, wird ihnen eine Lösung aus dem Eiweißbaustein und abgetöteten Krankheitserregern gespritzt. Zusätzlich wird ihnen zweimal ein Bakteriengift in die Bauchhöhle gespritzt und die Entwicklung der Symptome der EAE werden beobachtet. Sie reicht von Lähmungserscheinungen des Schwanzes über die Hinterbeine bis zu den Vorderbeinen, bevor die Tiere schließlich im Sterben liegen. Mäuse, die eine Querschnittslähmung zeigen oder deren Vorderbeine gelähmt sind, werden auf nicht genannte Weise getötet; dies betrifft in diesem Versuch drei Tiere. Am Höhepunkt der Erkrankung werden erkrankte und gesunde Mäuse in einem speziellen Halter fixiert und durch ein gasförmiges Narkosemittel betäubt. Der Kopf der Tiere wird in Vibration versetzt und mit einem bildgebenden Verfahren untersucht. Danach werden die Mäuse mit einer Überdosis Narkosemittel getötet und das Blut in ihrem Körper durch eine konservierende Lösung ersetzt. Ihr Gehirn wird entnommen und untersucht. Es soll herausgefunden werden, ob die Gehirne von männlichen und weiblichen Mäusen durch die Erkrankung in unterschiedlichem Ausmaß weicher werden (5).

Die meisten MS-Experimente werden an Mäusen gemacht. (Bild: Vasiliy Koval Adobestock)
In einem anderen Experiment werden Mäuse, die hochsoziale Rudeltiere sind, einzeln in Käfigen gehalten. Durch Fütterung einer Chemikalie wird das schützende Myelin abgebaut; 7, 25 und 45 Tage nach der Fütterung werden die Tiere getötet, um das Ausmaß der Gehirn-Schäden zu analysieren.
Eine zweite Gruppe von Mäusen wird mit Lysolecithin behandelt, wodurch gezielt bestimmte Regionen im Gehirn geschädigt werden. Hierzu werden die Mäuse betäubt, der Kopf der Tiere wird in einem stereotaktischen Apparat fixiert, in den Schädelknochen wird ein Loch geschnitten und die Substanz wird mit einer Nadel an bestimmte Stellen im Gehirn gespritzt, wo sie das Myelin zerstört. Nach 7 Tagen werden die Tiere getötet. Dafür werden sie mit dem kaum schmerzstillenden Inhalations-Anästhetikum Isofluran betäubt, ihr Brustkorb wird aufgeschnitten und eine konservierende Lösung wird gegen das Blut ausgetauscht.
Für eine andere Untersuchung werden Mäuse betäubt und Elektroden operativ ins Gehirn eingepflanzt. 7-10 Tage später werden an den unbetäubten Tieren über die Elektroden Nervensignale aufgezeichnet, bevor, während und nachdem sie Ton-Reizen ausgesetzt werden. Nach den Tests werden die Tiere durch eine gespritzte Substanz getötet. Des Weiteren werden die Mäuse einem sogenannten Angstkonditionierungs-Test unterzogen. Hierbei wird jeweils eine Maus in eine kleine Kammer eingeschlossen und ihr werden Töne vorgespielt, die teilweise mit Elektroschocks kombiniert werden (über den Boden der Kammer verabreicht), um ein Angstverhalten anzutrainieren. An einem Tag wird jede Maus sechsmal einer Ton-Elektroschock-Behandlung ausgesetzt. Nach 24 Stunden wird geprüft, ob das Tier auf den alleinigen Ton, ohne Elektroschock, mit Angststarre reagiert. An einem weiteren Tag wird die Prozedur in ähnlicher Form mit denselben Tieren wiederholt.
Folgen einer Myelin-Zerstörung sind u.a. Störungen des Hör- und Sehvermögens, sowie eine gestörte Wahrnehmung und Motorik. Den Prozess der Myelin-Zerstörung rückgängig zu machen, ist ein therapeutischer Ansatz, welcher bereits an menschlichen Probanden untersucht wird – und trotzdem werden dafür nach wie vor qualvolle Tierversuche gemacht (6).
Als Grund für eine Versuchsreihe mit 10 Weißbüscheläffchen wird die schlechte Korrelation zwischen Behandlungserfolgen bei „Tiermodellen“ für Multiple Sklerose und der Anwendung beim Patienten angegeben. Bei Weißbüscheläffchen verläuft die Krankheit variabel, dramatisch und schnell mit schweren Lähmungserscheinungen, so dass sie tot sind, bevor man eine Behandlung ausprobieren kann. Hier stellen die Autoren ein neues „Tiermodell“ vor, bei dem die Affen nicht so schnell sterben.
Unter Betäubung erhalten sechs Affen vier Injektionen einer Mischung aus rekombinantem (genveränderten) Nervenscheidenprotein von Ratten und eine reizende Mischung aus Mineralöl und abgetöteten Tuberkulosebakterien unter die Haut an den Schultern und den Hüften. Das körpereigene Abwehrsystem wird dadurch in Alarmbereitschaft versetzt. 70 Tage danach wird unter Narkose der Kopf der Tiere in ein stereotaktisches Gestell eingespannt und ein Loch wird in den Schädelknochen gebohrt. Mit einer Kanüle wird in das Hirngewebe gestochen und bestimmte Entzündungsfaktoren werden injiziert. Dies bewirkt, dass die körpereigene Immunabwehr die Myelinscheiden im Bereich der Injektion angreift und zerstört, was Symptomen der menschlichen MS ähneln soll.
Die Tiere leiden unter Lähmungen der Beine. Im Verlauf des Experiments werden drei Blutproben entnommen und der Kopf der Tiere wird dreimal mit einem bildgebenden Verfahren gescannt. Die Tiere werden dafür betäubt. Bei drei Affen wird genauso vorgegangen, nur dass diese Tiere vor der ersten Injektion mit einem Multiple-Sklerose-Medikament behandelt werden, das sich bereits in Phase III der klinischen Studien mit Humanpatienten befindet. 90 Tage nach der ersten Injektion werden alle Affen durch Überdosis eines Narkosemittels getötet und das Gehirn untersucht (7).

Weißbüscheläffchen werden oft in der MS-Forschung verwendet. (Foto: amphawan Adobestock)
Warum Tierversuche in der MS-Forschung scheitern
Grundsätzlich liegt den MS-Tierversuchen dasselbe problematische Prinzip zugrunde wie allen Tierversuchen: junge, gesunde Tiere werden geschädigt, so dass sie Symptome der Krankheit zeigen, wie man sie beim Menschen beobachtet. Insbesondere bei MS müssen auch die Autoren, die grundsätzlich die verfügbaren „Tiermodelle“ verteidigen, zugeben, dass es kein Modell gibt, welches alle Symptome der Krankheit zeigt, sondern immer nur bestimmte, isolierte (4).
Häufig werden die sogenannten EAE-Modelle verwendet, es wird also eine Experimentelle Autoimmune Enzephalomyelitis induziert. Dazu wird Nagern wie Mäusen oder Ratten ein Antigen zusammen mit einem Wirkverstärker gespritzt, meist das sogenannte Freund-Adjuvanz, eine Emulsion aus Wasser und Paraffinöl, in dem ggf. noch abgetötete Tuberkulose-Bakterien enthalten sind. Dies führt zu einer Entzündungsreaktion und damit Schädigung des Rückenmarks, auch teilweise zu Läsionen des Kleinhirns und des optischen Nervs. Allerdings sind die EAE-Läsionen hauptsächlich gekennzeichnet durch Degeneration, also Abbau der Axone und weniger durch Demyelinisierung – ein fundamentaler Unterschied zu den Schäden, die man bei MS-Patienten findet. Ebenso die Demyelinisierung des Vorderhirns und der grauen Substanz sowie weitere MS-Charakteristika der weißen Substanz kann das EAE-Modell nicht rekapitulieren (8).
Nur Mäuse können mit dem Theiler's Murine Encephalomyelitis Virus (TMEV) infiziert werden, wodurch sie ähnliche Symptome wie EAE-Nager zeigen, allerdings degenerieren hier zuerst die Axone und erst dann das Myelin – also genau andersherum, als es beim Menschen zu beobachten ist.
Eine weitere Methode ist die Zugabe der Chemikalie Cuprizon in das Futter, was meist bei Mäusen, aber auch bei Ratten durchgeführt wird. Der Stoff tötet auf einem bis heute nicht verstandenen Weg Oligodendrozyten im Gehirn ab, was im Laufe der Zeit zu Lähmungserscheinungen führt. Unterschiedliche Mausstämme zeigen allerdings auch andere Läsionsmuster im Gehirn, das Geschlecht der Tiere hat ebenfalls einen Einfluss und zudem bilden sich Mega-Mitochondrien in der Leber, ein Zeichen für einen gestörten Stoffwechsel, der möglicherweise für den Tod der Oligodendrozyten verantwortlich ist (4). Insbesondere aber die Leber ist ein wichtiges Organ, wenn es um die Wirksamkeit und Verträglichkeit von Medikamenten geht, so dass es fraglich ist, welche Effekte dies auf die ohnehin geringe Übertragbarkeit von Ergebnissen aus der Medikamentenforschung hat. Dazu kommt, dass diese Lähmungen ausheilen, sobald Cuprizon nicht mehr verabreicht wird (8). In frühen Phasen der Krankheit findet zwar auch beim Menschen eine Remyelinisierung statt, allerdings aus völlig anderen Gründen. Somit kann im „Tiermodell“ der entscheidende Aspekt, nämlich welcher Mechanismus einen neuen Schub auslöst, nicht untersucht werden. Genau dies zu verhindern wäre aber ein extrem wichtiger Ansatzpunkt für eine Therapie.
Neben den häufig eingesetzten Mäusen werden auch Zebrafische und Primaten wie Weißbüscheläffchen in verschiedenen Versuchen, wie weiter oben beschrieben, eingesetzt. Aber: Selbst die Kombinationen aus verschiedenen (genetisch veränderten) Tierstämmen, den oft bemühten und hochgelobten humanisierten Mäusen und Antigenen können immer nur Teile der Symptome in einem artfremden System erzeugen.
In den letzten Jahren sind einige MS-Medikamente neu zugelassen worden und generell ist die Erfolgsquote bei MS-Medikamenten mit 27 % höher als der Durchschnitt aller Medikamentenklassen von gerade mal 8 % (9,10), allerdings gibt es bis heute lediglich Therapien, um die Schübe abzumildern und die Häufigkeit zu verringern, aber keine Behandlung für die langsam und kontinuierlich fortschreitende Verschlechterung der darunter liegenden Symptomatik. Zudem bauen viele der in den letzten Jahren zugelassenen Medikamente auf älteren auf – es sind teilweise Weiterentwicklungen von Stoffen, die bereits länger auf dem Markt sind, so dass die Wahrscheinlichkeit recht hoch ist, dass sie sowohl beim Tier als auch beim Menschen wirken und so die Quote zustande kommt.
Auch wenn jeder (MS-)Patient froh ist über jede neue Art der Therapie, insbesondere die Immuntherapien sind mit starken Nebenwirkungen verbunden. Im Prinzip wirken die meisten dieser Medikamente über eine Unterdrückung der körpereigenen Immunabwehr – man muss kein Arzt sein, um zu ahnen, dass dies Nachteile mit sich bringt.
Bis zur Zulassung der Interferone wurden lediglich die Schübe mit hochdosiertem Kortison behandelt. Einen tatsächlichen Nutzen haben aber längst nicht alle MS-Patienten, denn bei lediglich 9 von 100 zeigte sich keine weitere Zunahme der Beeinträchtigung und nur 15 von 100 Patienten blieben schubfrei. Andere Medikamente zeigen eine teilweise Wirksamkeit bei einer größeren Zahl an Patienten, mehr als 40 von 100 profitieren allerdings in keinem Fall, Nebenwirkungen dagegen sind sehr häufig (11).
Die monoklonalen Antikörper, die seit einigen Jahren eingesetzt werden, sind gut wirksam – haben aber auch heftige Nebenwirkungen. Daclizumab zum Beispiel wurde 2018 vom Markt genommen, da es akutes Leberversagen und Gehirnentzündungen auslöste (12). Alemtuzumab ist zwar auf dem Markt, aber als Reservemedikament eingestuft und wird kaum noch verordnet, da es bei 30% der Behandelten zu einer weiteren Autoimmunerkrankung führte, zudem erleiden 90 % Nebenwirkungen wie Kopfschmerzen, Fieber und Allergien, dazu kommt ein erhöhtes Infektionsrisiko. Besonders beunruhigend: in manchen Fällen können die Nebenwirkungen sogar nach Absetzen mancher MS-Medikamente bestehen bleiben (13).
Vor diesem Hintergrund ist es wenig verwunderlich, dass eine umfangreiche Informationsbroschüre des Universitätsklinikums Hamburg-Eppendorf folgende Bilanz zieht: „[…] Der Preis für eine hohe Effektivität in der Verhinderung von Schüben sind mitunter ebenso hohe Nebenwirkungen. Und etwas ernüchternd gilt: Der Langzeitnutzen bleibt unklar. Ein direkter Effekt auf den degenerativen Anteil der Erkrankung, bei dem Nervenzellstrukturen zerstört werden und der vermutlich für einen Großteil der bleibenden Beeinträchtigung verantwortlich ist, konnte bislang nicht gezeigt werden. […]“ (11).
Sicherlich hat dies viele Gründe, aber das Festhalten an artifiziellen, artfremden Systemen, die die menschliche Situation nicht widerspiegeln können, und die aber trotzdem Voraussetzung für eine Marktzulassung sind, ist ein großes und unterschätztes Manko.
Die bessere Wahl: Alternativen
Es gibt sehr viele Faktoren, die möglicherweise eine Rolle bei der Entstehung, beim Ausbruch und beim Krankheitsverlauf spielen können. Insbesondere bei MS sind es die Bevölkerungsstudien, die bisher das meiste Licht ins Dunkel gebracht haben.
Bereits 2006 wurde ein Zusammenhang zu einem Vitamin D-Mangel aufgezeigt (14). Ebenso zog eine neue Studie mit rund 20.000 Probanden, die Hälfte davon mit diagnostizierter MS, die Bilanz, dass mindestens 13 % der MS-Fälle verhindert werden könnten, wenn auf Rauchen verzichtet wird (15).
Auch der Darm, dessen mannigfaltiger Einfluss auf viele verschiedene Erkrankungen erst in der jüngsten Vergangenheit in den Fokus rückte, scheint bei MS eine Rolle zu spielen, da bei MS-Patienten sowohl die Darmflora (16) als auch das Mykobiom (17) bestimmte Veränderungen zeigen. Dies kann nicht nur auf das Fortschreiten der Krankheit, sondern auch auf die Reaktion auf Therapien Einfluss haben.
Mathematische Modelle nutzen auch Daten aus Bevölkerungsstudien. So konnte in einer Arbeit, die Patientendaten aus 20 Jahren auswertete, gezeigt werden, dass trotz der Unterschiede in den verschiedenen MS-Subtypen, es eine gemeinsame Pathogenese zu geben scheint – eine wichtige Erkenntnis für die weitere Therapieentwicklung (18).
Die wohl größte Welle hat 2022 eine Publikation geschlagen, bei der die Daten von 10 Millionen Menschen ausgewertet wurden. Möglich war eine so große Datenmenge aus einer Kollaboration mit dem US-Militär, so dass Daten von 1993 bis 2013 zur Verfügung standen. Von 801 Personen, die während des Militär-Dienstes an MS erkrankten, wies nur eine Person keine Infektion mit dem Epstein-Barr-Virus (EBV) auf. Bilanz ist, dass es sehr wahrscheinlich ist, dass die Infektion mit dem Virus die Hauptursache für MS ist. Zwar ist die Infektion mit diesem humanen Herpesvirus sehr verbreitet und die Vermutung, dass eine EBV-Infektion mit MS in Zusammenhang steht, existiert seit Jahren, aber ein so klarer Bezug war bisher nicht belegt (19).
Somit scheint ein wichtiger Baustein bezüglich der Ursache für MS freigelegt. EBV ist ein humanpathogenes Virus, so dass insbesondere unter diesem Aspekt die Krankheitsentstehung, -progression sowie potenzielle Therapien in humanen Systemen untersucht werden sollten bzw. müssen.
Zellkulturen werden, wie in praktisch allen anderen Bereichen, auch bei der MS-Forschung eingesetzt, um grundlegende Mechanismen auf Zellebene zu untersuchen. Besonders geeignet sind hier Zellen, die von MS-Patienten gewonnen werden, da diese die krankheitsspezifischen Informationen konserviert haben. Zum Vergleich können Zellen von gesunden Spendern verwendet werden. So konnten in verschiedenen Arbeiten die Beteiligungen bestimmter Proteine wie Rezeptoren, aber auch der Einfluss von Neurotransmittern an dem Krankheitsmechanismus untersucht sowie Biomarker identifiziert werden (20–22).
Besonderes Augenmerk liegt auf den Oligodendrozyten, den Myelin produzierenden Zellen. Durch Rückprogrammierung anderer Körperzellen (z.B. einer Haarwurzelzelle) können sogenannte iPSCs (= induzierte pluripotente Stammzellen) von MS-Patienten gewonnen werden. Diese können dann in beliebige Zellen weiter differenziert werden - z.B. erst in Vorläufer-Oligodendrozyten, die sich dann zu reifen Oligodendrozyten entwickeln. So kann eine Oligodendrozyten-Zelllinie angelegt werden.
Werden diese Zellen von MS-Patienten gewonnen, die in einer stabilen Phase der MS sind, zeigen sie unter normalen Bedingungen keine sonderlichen Auffälligkeiten. Wird aber ein körpereigenes Interferon, von dem man weiß, dass es eine negative Rolle bei MS spielt, zu der Kultur zugegeben, zeigt sich, dass die Differenzierung der Oligodendrozyten stark vermindert ist. Können die Vorläufer-Oligodendrozyten sich nicht zu reifen Oligodendrozyten differenzieren, ist auch die Neubildung des Myelins eingeschränkt. Bei MS Patienten führt die verminderte Myelinisierung zu der eingeschränkten Erregungsleitung der Nerven, die dann die Lähmungs- und Empfindungseinschränkungen hervorruft. So eine Zellkultur kann daher verwendet werden, um verschiedene Kombinationen von Entzündungsstoffen zuzugeben und herauszufinden, welche wie stark die Oligodendrozytendifferenzierung und damit die Myelinisierung beeinflussen. Dieses Wissen kann wichtig sein, um zu verstehen, wie verschiedenartig und effektiv Therapien bei unterschiedlicher entzündlicher Umgebung der Zellen wirken können (23).
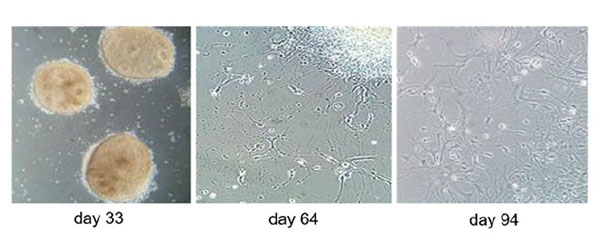
Verschiedene Reifestadien der iPSC-Oligodendrozyten.
(Bild: Morales Pantoja et al. PLoS One 2020)
Anders als die klassischen 2D-Zellkulturen gibt es auch dreidimensionale Modelle: Neurosphären sind frei in einer Lösung schwebende Nervenzellcluster, von denen vor allem Vorläuferzellen zu Forschungszwecken genutzt werden können. Diese Methode, bei der die Sphären auch fusionieren, wurde weiterentwickelt, so dass zudem auch mehrere Zelltypen enthalten sind (24).
Mittels eines aus menschlichen iPSCs generierten 3D-Gehirnorganoidmodells, auch BrainSphere genannt, können die Myelinisierungs- und Demyelinisierungsprozesse bei den Axonen untersucht werden, die entscheidend bei dieser Krankheit sind. Eine das Myelin schädigende Substanz, die als Positivkontrolle diente, zeigte auch in diesem Modell einen Angriff auf das Myelin, während Ibuprofen (Negativ-Kontrolle) keine Wirkung zeigte. Somit eignet sich das Modell zur Testung von potenziell schädlichen Stoffen, die das Myelin angreifen können (25).
Organoide haben den Vorteil, dass sie komplexer sind als die klassischen 2D-Zellmodelle und besser die Situation des Menschen darstellen können. Die 3D-Zellmodelle können entweder aus Primärzellen gewonnen oder über die iPSCs (induzierte pluripotente Stammzell)-Technologie hergestellt werden. Für Ersteres muss eine Biopsie aus dem betreffenden Gewebe genommen werden – wenn diese medizinisch sowieso geplant ist, können Zellen abgezweigt werden. Oft ist dies aber nicht der Fall und inzwischen auch nicht mehr nötig, da die iPSC-Technologie zur Verfügung steht. Diese bietet sich insbesondere bei der Erforschung von Krankheiten wie MS an, da dort vor allem auch das Gehirn betroffen ist und man Patientenhirnzellen oft nicht zur Verfügung hat.
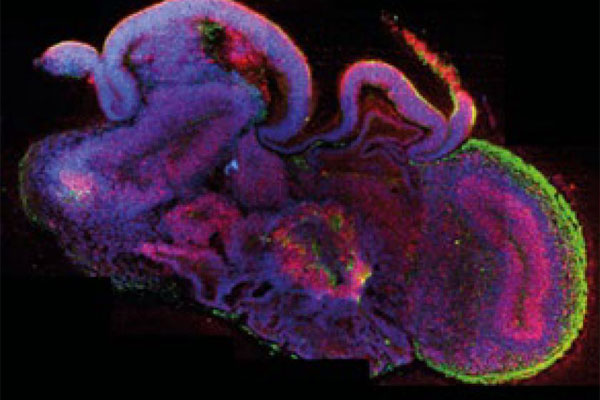
Gehirn-Organoid. (Bild: Lancaster, M.A. Nature 2013; 501: 373-379)
So können zum Beispiel (neben Kontroll-Organoiden von gesunden Spendern) patientenspezifische Organoide generiert werden, und zwar von allen drei MS-Formen: der schubförmig remittierenden, sekundär progredienten und der primär progredienten MS. Auf diese Weise können auch die (möglichen) Unterschiede der verschiedenen Verlaufsformen untersucht werden. Mittels dieser Organoide konnte beispielsweise festgestellt werden, dass in den MS-Formen, vor allem aber bei PPMS, die Differenzierung der Oligodendrozyten im Vergleich zu den gesunden Organoiden verringert ist, also der Zellen, die für den Aufbau des Myelins verantwortlich sind. Zudem wurde eine geringere Expression eines Zellzyklusinhibitors festgestellt, so dass sich hier ein möglicher therapeutischer Ansatz bietet (26).
Der 3D-Biodruck verbreitet sich seit ein paar Jahren und bietet auch für MS großes Potenzial. Genutzt wird die Technik aktuell vor allem, um die MS-typischen Schäden in den Gehirnen von Patienten exakt abzubilden. Diese Methode ist präziser und genauer als die MRT-Scans und ein besseres Verständnis der Läsionen hilft letztendlich bei dem Verständnis der Krankheitsprogression und somit bei Verbesserungen von Therapien.

3D-Druck des Gehirns eines MS-Patienten. (Bild: José Santoyo, Stratasys)
Die humanbasierten Methoden bieten neben der Erforschung aber auch die Möglichkeit einer direkten patientenspezifischen Therapie: Ein neues Forschungsprojekt der Universität Aarhus (Dänemark) zielt darauf ab, mit Hilfe von elektrogesponnenen Fasern neue, künstliche, myelinisierte Nervenfasern zu schaffen (27). Bis dieses tatsächlich in der Klinik zum Einsatz kommt, kann noch etwas Zeit vergehen, aber gemessen daran, wie rapide sich die humanbasierten, modernen Methoden in den letzten Jahren trotz völlig unzureichender Finanzierung entwickelt haben, könnte es schneller als erhofft Realität werden.
13.04.2023
Dipl.-Biol. Julia Radzwill
Quellen
- Deutsche Multiple Sklerose Gesellschaft Bundesverband e.V. Website
- DocCheck Flexikon. Multiple Sklerose
- Pschyrembel Online. Multiple Sklerose
- Burrows DJ et al. Animal models of multiple sclerosis: From rodents to zebrafish. Multiple Sclerosis Journal 2019; 25(3):306–324
- Batzdorf C.S. et al. Sexual dimorphism in extracellular matrix composition and viscoelasticity of the healthy and inflamed mouse brain. Biology 2022; 11(2):230
- Cerina M. et al. The quality of cortical network function recovery depends on localization and degree of axonal demyelination. Brain, Behavior, and Immunity 2017; 59:103–117
- Stassart R.M. et al. A new targeted model of experimental autoimmune encephalomyelitis in the common marmoset. Brain Pathology 2016; 26(4):452–464
- Kipp M. et al. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology 2017; 27(2):123–137
- De Gasperis-Brigante C.D. et al. Reducing clinical trial risk in multiple sclerosis. Multiple Sclerosis and Related Disorders 2016; 5:81–88
- Thomas D et al Clinical Development Success Rates, 2021.
- UKE Hamburg. Immuntherapien der schubförmigen Multiplen Sklerose 2021. 2021
- Ärzte gegen Tierversuche e.V. Schwerwiegende Nebenwirkungen bei Multiple-Sklerose-Medikament, 6.3.2018
- Neurologie Essen. Aktuelle Therapiemöglichkeiten der schubförmigen MS, 2021
- Munger K.L. et al. Serum 25-Hydroxyvitamin D levels and risk of Multiple Sclerosis. JAMA 2006; 296(23):2832–2838
- Manouchehrinia A. et al. Smoking attributable risk in Multiple Sclerosis. Frontiers in Immunology 2022; 13
- iMSMS Consortium. Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course. Cell 2022; 185(19):3467-3486
- Shah S. et al. Alterations of the gut mycobiome in patients with MS. eBioMedicine 2021; 71
- Kotelnikova E. et al. Dynamics and heterogeneity of brain damage in multiple sclerosis. PLoS Computational Biology 2017; 13(10):e1005757
- Bjoernevik K et al. Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. Science 2022; 375(6578):296-301
- Faigle W. et al. Brain citrullination patterns and T Cell reactivity of cerebrospinal fluid-derived CD4+ T cells in Multiple Sclerosis. Frontiers in Immunology 2019; 10:540
- Etesam Z. et al. Different expressions of specific transcription factors of Th1 (T-bet) and Th2 cells (GATA-3) by peripheral blood mononuclear cells from patients with Multiple Sclerosis. Basic and Clinical Neuroscience 2018; 9(6):458–469
- Clottu A.S. et al. EBI2 expression and function: Robust in memory lymphocytes and increased by Natalizumab in Multiple Sclerosis. Cell Reports 2017; 18(1):213–224
- Pantoja I.E.M. et al. iPSCs from people with MS can differentiate into oligodendrocytes in a homeostatic but not an inflammatory milieu. PLoS ONE 2020; 15(6):e0233980
- Watanabe F. et al. Generation of Neurosphere-Derived Organoid-like-Aggregates (NEDAS) from neural stem cells. Current Protocols 2021; 1(2):e15
- Chesnut M. et al. Human iPSC-derived model to study myelin disruption. International Journal of Molecular Sciences 2021; 22(17):9473
- Daviaud N. et al. Cerebral organoids in primary progressive multiple sclerosis reveal stem cell and oligodendrocyte differentiation defect. Biology Open 2023; 12(3):bio059845
- Drug Target Review Drug Target Review: New treatment for MS using artificial nerve fibres. 24.01.2023
