Organoide und Multi-Organ-Chips
Tierversuchsfreie Forschung im 21. Jahrhundert
Heutige In-vitro-Modelle, die für die biomedizinische Forschung genutzt werden, sind komplexer und physiologischer denn je. Sie reichen von dreidimensionalen Zellkulturen über Organoide bis hin zu Multi-Organ-Chips, auf denen mehrere Organmodelle kombiniert und mit einem simulierten Blut- und Urinkreislauf miteinander verbunden werden. Diese humanen Zellmodelle können aus induzierten pluripotenten Stammzellen (iPSCs) gezüchtet werden, sowohl von gesunden Spendern als auch von Patienten. Vor allem als Krankheitsmodelle und für die Entwicklung von Medikamenten oder die Testung von giftigen Substanzen sind sie hochrelevant. Viele dieser Systeme wurden bereits erfolgreich validiert, insbesondere für den Bereich der gesetzlich vorgeschriebenen Tierversuche wie die Sicherheitsprüfung von Chemikalien. Kontinuierliche Optimierungen, u.a. hinsichtlich der Integration von Blutgefäßen und Immunsystem, führen dazu, dass die humanbasierten In-vitro-Modelle die Problematik der mangelnden Übertragbarkeit von Tierversuchen auf den Menschen überwinden können.
In den vergangenen 10 Jahren hat die humanbasierte In-vitro-Forschung eine spektakuläre Entwicklung hingelegt. Forschern ist es um das Jahr 2010 erstmals gelungen, sogenannte Organoide im Labor zu züchten (1–3). Dabei handelt es sich um dreidimensionale humane Zellkulturen, die das Erscheinungsbild und die Funktion eines menschlichen Organs erstaunlich gut widerspiegeln (4). Für die wissenschaftliche Diskussion um die Abschaffung von Tierversuchen spielt die Etablierung dieser Systeme und ebenso die Entwicklung von komplexen Computersimulationen (In-silico-Verfahren) eine entscheidende Rolle. Mit diesen Verfahren stehen nun Forschungsmodelle zur Verfügung, die bereits heute eine bessere Vorhersagekraft für den Menschen haben als Tierversuche, wie erste Vergleichsstudien zeigen (5-7).
- in vivo = im Lebenden
- in vitro = im Reagenzglas
- in silico = im Computer
Bis dato wurden in der biomedizinischen In-vitro-Forschung hauptsächlich zweidimensionale Zellkulturen eingesetzt. Dabei handelt es sich um „unsterbliche“ Zelllinien, die eine flache Zellschicht bilden. Solch ein Modell ist von Aufbau und Funktion eines dreidimensionalen Organs weit entfernt. Zudem bestehen diese Zellkulturen nur aus einem bestimmten Zelltyp, während ein echtes Organ verschiedene Zelltypen mit spezialisierten Funktionen enthält. Ein weiterer Nachteil solcher Zelllinien ist, dass sie für die kontinuierliche Kultivierung im Labor entweder künstlich „unsterblich“ gemacht wurden oder von einem Tumor abstammen. Für die Kultivierung dieser Zellen wird dem Nährmedium fötales Kälberserum (FKS) zugesetzt. Das Serum wird aus dem Blut ungeborener Kälber gewonnen, was nicht nur ethisch bedenklich ist, sondern auch wissenschaftliche bzw. experimentelle Nachteile mit sich zieht (8).
Die modernen 3-dimensionalen Zellkultursysteme wie Organoide haben nicht nur zahlreiche Vorteile gegenüber der alt bekannten Zelllinien, sondern auch gegenüber Tierversuchen. Die Übertragbarkeit von Forschungsergebnissen aus tierexperimentellen Studien auf den Menschen ist unzureichend und wird zunehmend kritisch gesehen. Aus diesem Grund ist die Entwicklung und Etablierung humanbasierter In-vitro-Forschungsmodelle vor allem für die Testung von Medikamenten und die Erforschung humaner Krankheiten essentiell. Die humanbasierten In-vitro-Modelle wie Organoide haben zudem den einzigartigen Vorteil, dass sie eine personalisierte, also auf den einzelnen Menschen individuell zugeschnittene, Medizin ermöglichen.
Züchtung und Eigenschaften von Organoiden
Humane Organoide werden basierend auf menschlichen Stammzellen gezüchtet (9). Hierbei werden entweder Stammzellen aus Gewebebiopsien (z.B. Darm, s. Abb. 1) isoliert oder es werden Haut- oder Haarwurzelzellen eines menschlichen Spenders durch gentechnische Verfahren zu induzierten pluripotenten Stammzellen (iPSC: induced pluripotent stem cell) umprogrammiert. Auch Zahnmark oder Blut dienen den Forschern als Quelle für Stammzellen zur Generierung dreidimensionaler Zellkultursysteme. Großer Vorteil des iPSC-basierten Verfahrens ist, dass die Gewinnung der Spenderzellen für den Menschen unkompliziert und schmerzfrei ist und dass die geschaffenen iPSCs in vitro praktisch jedes beliebige Organoid bilden können.
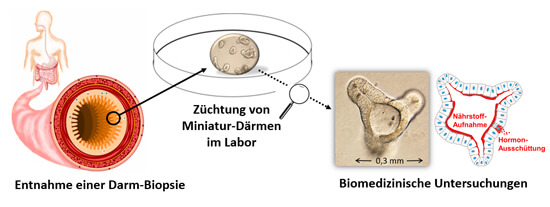
Abb. 1: Aus einer Darmbiopsie werden im Labor Darmorganoide in einen Geltropfen eingebettet und in einer Zellkulturschale gezüchtet. Die Darmorganoide können Nährstoffe absorbieren und Hormone sezernieren, die im menschlichen Körper den Stoffwechsel und Blutzucker regulieren.
Durch Anpassung der Kulturbedingungen, insbesondere der eingesetzten Wachstumsfaktoren, werden dann beispielsweise Darm-, Gehirn-, Leber- oder Nierenorganoide gezüchtet (Abb. 2). Die Organoide sind komplexe dreidimensionale Gebilde aus verschiedenen Zellarten, die in der Regel einen halben bis einen Millimeter groß sind. Sie lassen sich über mehrere Wochen oder Monate in Zellkulturplatten kultivieren und praktisch unbegrenzt in vitro vermehren. Sowohl iPSCs als auch die Organoide selbst können in gefrorenem Zustand gelagert werden, so dass aktuell riesige Biobanken geschaffen werden, die iPSCs oder Organoide etlicher menschlicher Spender (gesunder und erkrankter) enthalten (10). Auf diese Weise können bei Bedarf Proben aufgetaut und wieder in Kultur genommen werden, um die gewünschten Testungen daran durchzuführen. Organoide konservieren in vitro die Eigenschaften des Zellspenders, so dass sie ein ideales Krankheitsmodell für die biomedizinische Forschung darstellen, wenn man sie aus Patienten generiert. Zudem können Organoide in vitro gentechnisch so verändert werden, dass gezielt Krankheitsgene entweder korrigiert (11) oder eingebaut (12) werden. Solche Krankheitsmodelle sind wesentlich aussagekräftiger als gentechnisch veränderte „Tiermodelle“.
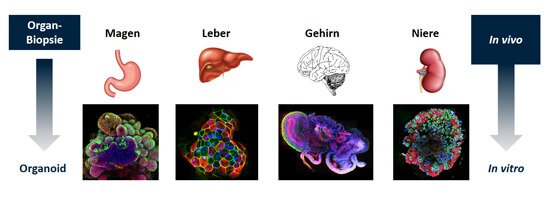
Abb. 2: Da alle Organe ihre eigenen Stammzellen besitzen, kann aus jedem Organ im Labor ein Organoid gezüchtet werden. An den unterschiedlichen Farben bei den Fluoreszenz-mikroskopischen Aufnahmen sieht man, dass die Organoide komplexe und vielfältige Strukturen aufweisen, die denen des echten Organs ähneln.
Organoide ermöglichen personalisierte Medizin
Sowohl die molekularen Ursachen menschlicher Erkrankungen, als auch therapeutische Ansätze lassen sich mithilfe dreidimensionaler Zellmodelle wie der Organoide exzellent erforschen (13). Gehirnorganoide oder andere komplexe neuronale Zellmodelle wurden bereits aus Patienten gezüchtet, die an Alzheimer (14), Parkinson (15), Schizophrenie (16,17) und Autismus (17) oder Chorea Huntington (18) leiden. Bei neurologischen Erkrankungen wie Morbus Alzheimer besteht eine besonders dringende Notwendigkeit, neue Modellsysteme zu etablieren, die auf menschlichen Zellen basieren, da die bisherige Forschung an hunderten „Tiermodellen“ bis heute keine zufriedenstellende Behandlung ermöglicht (19–21).
Unzureichende Wirksamkeit und inakzeptable Nebenwirkungen führen häufig dazu, dass Therapien abgebrochen werden müssen oder Medikamente sogar zurückgezogen werden. Als Krankheitsmodell sind dreidimensionale In-vitro-Modelle, die man aus Patienten züchtet, ideal geeignet, da sie humanrelevante Ergebnisse liefern. Anhand von Nervenzellen, die aus iPSCs von magersüchtigen Patientinnen kultiviert wurden, konnte ein Gen identifiziert werden, das im Zusammenhang mit Anorexia nervosa zu stehen scheint (22). Humane Gehirnorganoide werden auch für die Krebsforschung eingesetzt, indem sie mit menschlichen Tumorzellen versetzt werden, so dass sich in ihnen Gehirntumore entwickeln (23). Anhand dieses In-vitro-Modells können dann Wirkstoffe hinsichtlich ihrer Wirksamkeit und Effektivität getestet werden.
Da jeder Mensch und auch jeder Tumor anders auf eine bestimmte Behandlung reagiert, ist es ein großer Vorteil, dass iPSC-basierte In-vitro-Modelle eine personalisierte Medizin ermöglichen. Diese ist bereits in der klinischen Anwendung angekommen: In Absprache mit dem behandelnden Onkologen wird eine Tumor-Biopsie des Patienten ins Labor geschickt, aus der Tumor-Organoide („Mikrotumore“) gezüchtet werden. Daran können dann diverse Therapiemöglichkeiten getestet werden und die individuell am besten wirksamen Medikamente werden dem Patienten schließlich verabreicht (24) (Abb. 3). Die Mikrotumor-Technologie eignet sich auch für die Erforschung neuer Medikamente, deren Wirksamkeit in den Tumororganoiden analysiert werden kann (25, 26). Die Entwicklung von Krebsmedikamenten in Tierversuchen birgt die Gefahr, dass die Ergebnisse nicht sicher auf den Menschen übertragbar sind. In Anbetracht der individuell unterschiedlichen Wirksamkeit beim Menschen bzgl. Effektivität und Nebenwirkungen von Krebsmedikamenten hat die personalisierte Krebstherapie ein enorm hohes Potenzial im Gegensatz zur Testung in artfremden Spezies wie Mäusen, in denen menschliche Tumore künstlich herangezüchtet werden (27).
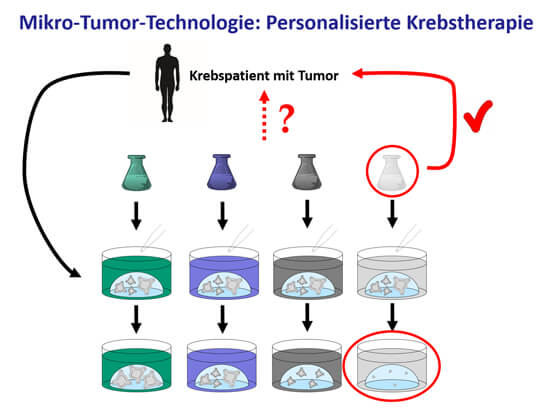
Abb. 3: Die Mikrotumor-Technologie ermöglicht eine personalisierte Krebstherapie. Aus einer Tumorbiopsie eines Patienten werden Tumor-Organoide in vitro kultiviert und vermehrt. Anschließend werden diverse Therapiemöglichkeiten daran getestet und dem Patienten letztendlich die Medikation verabreicht, die in vitro die beste Wirkung gezeigt hat.
Auch beim Thema Schlaganfall herrscht dringender Bedarf an neuen humanrelevanten Modellsystemen, da hunderte Wirkstoffe, die in der Vergangenheit in Tierstudien erfolgreich waren, bei klinischen Studien am Menschen versagen (28,29). Verantwortlich hierfür sind nicht zuletzt Tierversuche, deren experimenteller Aufbau nicht geeignet ist, um die menschliche Erkrankung nachzuahmen – beispielsweise durch das bloße Verschließen von Blutgefäßen bei Nagern mit einem Faden. Seit Jahren gibt es dreidimensionale In-vitro-Systeme, die aus humanen iPSCs generiert werden und für die Erforschung und Therapie des Schlaganfalls und seiner Begleiterscheinungen genutzt werden können (30). Für die Forschung im Bereich Multiple Sklerose sind diese Zellsysteme ebenfalls bestens geeignet, zumal sie, wie oben beschrieben, auch aus Patienten gezüchtet werden können (31, 32).
Multi-Organ-Chips: Simulation des menschlichen Körpers
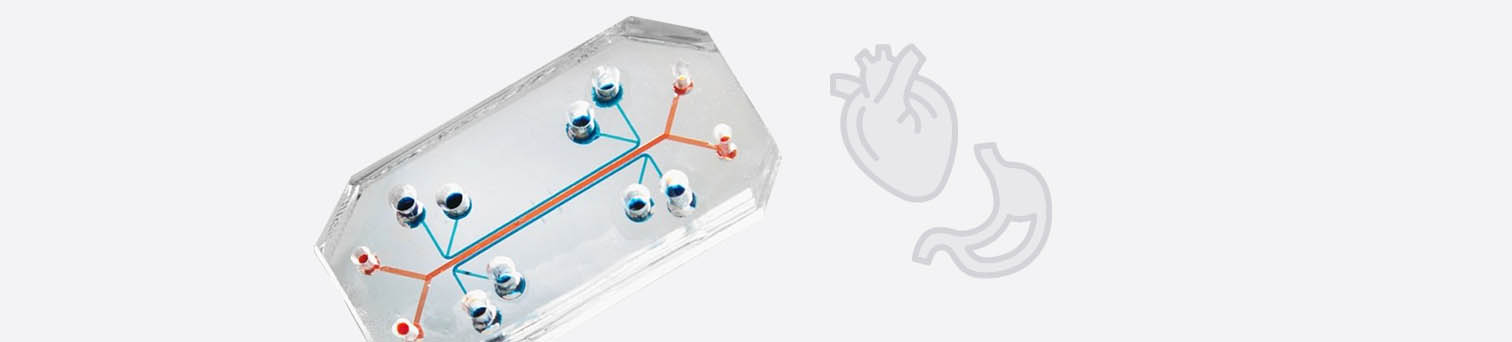
Ein In-vitro-System, das für die Zukunft der Biomedizin und Medikamentenentwicklung von höchster Bedeutung ist, ist der sogenannte Multi-Organ-Chip (MOC) (33). Bei MOCs werden mehrere Organoide oder ähnliche menschliche Zellmodelle auf einem Biochip untergebracht, auf dem sie über ein Mikrokanal-System miteinander verbunden sind (Abb. 4). Es ist mittlerweile möglich, bis zu 10 „Organe“ auf einem Chip zu platzieren (Abb. 5), so dass ein menschlicher Organismus gut simuliert werden kann (34). Die Mikrokanäle, die die Organe auf dem Chip miteinander verbinden, simulieren den Blutkreislauf und ggf. auch den Urinkreislauf, wenn sich ein Nierenmodell auf dem Chip befindet. Aus dem Mikrokanal-System können Proben entnommen werden, die einer Blutabnahme oder Urinprobe beim Patienten entsprechen. Die Organe auf dem Chip haben einen Stoffwechsel und können über das Mikrokanal-System miteinander interagieren und Stoffe austauschen. Verglichen mit der isolierten Kultivierung der einzelnen Organmodelle, verbessern sich beim MOC die Organ-spezifischen Funktionen teilweise sogar durch die Interaktion mit den anderen Organen. Der MOC wird an ein elektronisches Steuerungselement angeschlossen, so dass man diverse Messgrößen wie die Flussrate, oder die Reihenfolge, in der die Organe angesteuert werden, Computer-basiert regulieren kann.
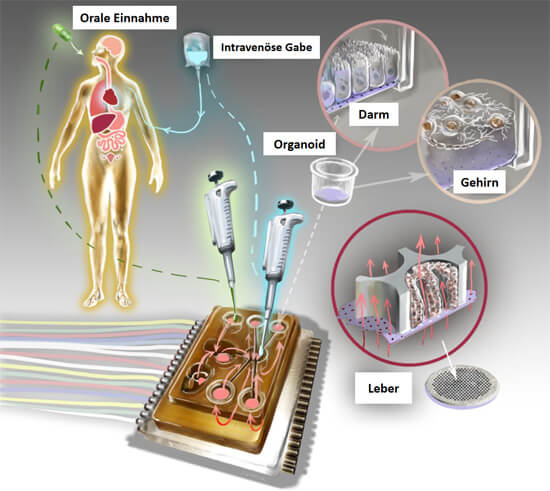
Abb. 4: Der Multi-Organ-Chip kann mit einzelnen Organoiden beliebig bestückt werden, er hat in etwa die Größe einer Streichholzschachtel. Über ein mikrofluidisches System werden die Organoide mit Nährstoffen versorgt und Medikamente eingeleitet. Hierbei kann eine orale Einnahme oder eine intravenöse Verabreichung simuliert werden. Das System ist an ein elektronisches Steuerungs-Element angeschlossen. Mittels Computer wird reguliert, welche Organe in welcher Reihenfolge angesteuert werden (modifiziert nach (31)).
In das System können Nährlösungen eingeleitet werden, aber auch Medikamente, Chemikalien oder Giftstoffe sowie Wirkstoff-Kombinationen. Bei der Testung kann eine intravenöse (in die Blutbahn) oder eine orale Gabe (über den Mund) bestimmter Substanzen simuliert werden. Soll ein bestimmtes Medikament beim Patienten oral verabreicht werden, wird es in dem MOC erst in den Darm geleitet, wo es aufgenommen wird, und erreicht dann die weiteren Organe wie Leber und Niere, wo es abgebaut und ausgeschieden wird. Gerade im Bereich der Toxikologie (Giftigkeitstestung) etablieren sich diese Systeme rasant, da sie humanrelevante Daten liefern.
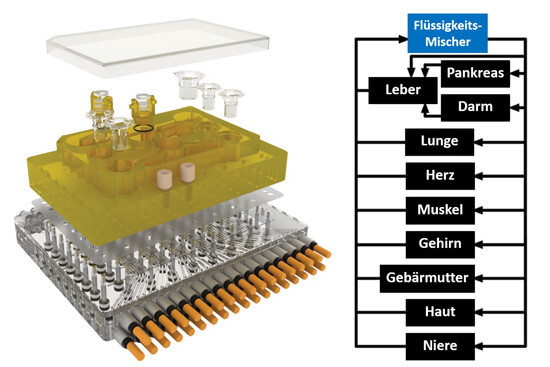
Abb. 5: Der 10-Organ-Chip enthält Einsätze für die Organoide und Anschlüsse für das elektronische Steuerungs-Modul. Über eine Pumpe wird das mikrofluidische System angetrieben, das alle Organoide auf dem Chip erreicht. Im Flüssigkeits-Mischer werden die Lösungen gemischt, die in das System eingeleitet werden oder darin zirkulieren. Die Pfeile zeigen eine beispielhafte Durchfluss-Richtung im Mikrokanal-System (modifiziert nach (31)).
Die Auswirkung der eingeleiteten Substanzen auf die einzelnen Organe kann untersucht werden, indem die Organmodelle vom Chip entnommen und analysiert werden. Auch der Abbau eines Wirkstoffs kann durch Analyse der entnommenen Proben aus dem Mikrokanal-System verfolgt werden (pharmakokinetische Untersuchungen). Das bekannte Schmerzmittel Diclofenac wurde beispielsweise im MOC getestet, und Verteilung und Abbau spiegeln in den Organmodellen und im Durchfluss-System die Verstoffwechselung des Medikaments im menschlichen Körper wider (34). In den Chip sind Komponenten wie eine Mikropumpe oder ph- und Sauerstoffsensoren integriert, die es ermöglichen, Blutdruck und Puls zu simulieren (35). Je nach wissenschaftlicher Fragestellung werden unterschiedliche und unterschiedlich viele Organe auf dem Chip platziert. So enthält ein MOC zur Erforschung von Diabetes ein Bauchspeicheldrüsen-Modell, sowie insulin-sensitive Organe wie Leber oder Muskel (36), während für die Erforschung von Fettleibigkeit Leber, Fettgewebe und ein Blutgefäß-Modell eingesetzt werden (37).
Die NASA finanziert ein Forschungsprogramm, bei dem MOCs mit modernen menschlichen Zellkultursystemen zum ISS National Lab, einem Labor auf der ISS-Raumstation, geflogen werden (38). Die MOCs, die im ISS-Labor im Weltraum getestet werden, simulieren beispielsweise ein humanes Immunsystem bestehend aus Immun-, Knochenmarks- und Blutgefäßzellen. Die Chips werden zwei Wochen lang im All getestet und anschließend eingefroren, um sie zu konservieren und nach ihrer Rückkehr zur Erde verschiedenen Analysen zu unterziehen. Man möchte auf diese Weise herausfinden, wie sich der Aufenthalt im Weltall auf den Alterungsprozess des menschlichen Immunsystem auswirkt, um daraus Rückschlüsse auf die körpereigenen Reparaturmechanismen zu ziehen. Des Weiteren wird ein Nieren-Chip zum ISS-Labor geschickt, sowie Knochen- und Knorpel-Chips und ein Chip, der die Blut-Hirn-Schranke abbildet. Für die Entzündungsforschung folgt noch ein Chip, auf dem Lunge und Knochenmark miteinander verbunden sind.
Computerbasierte Systeme
Hochrelevant sind auch In-silico-Verfahren, die in den letzten Jahren entwickelt wurden, um die Wirksamkeit und Giftigkeit von Substanzen im menschlichen Organismus vorherzusagen. Diese Computerprogramme haben nachgewiesenermaßen eine bessere Vorhersagekraft im Vergleich zu Tierversuchen (5–7). Derartige In-silico-Verfahren wie QSAR- (Quantitative Structure-Activity Relationship) oder PBKD- (Physiologically Based Kinetic and Dynamic) Modelle sind von der europäischen Institution ECVAM und der weltweiten OECD bereits validiert und als Alternative zu Tierversuchen im regulatorischen Bereich akzeptiert (39).
Bildgebende Verfahren gibt es schon seit vielen Jahrzehnten und sie werden stetig weiterentwickelt und optimiert. Relevante Erkenntnisse für den Bereich der humanmedizinischen Grundlagenforschung lassen sich an menschlichen Patienten auf diese Weise direkt gewinnen. Hierzu zählen beispielsweise die Computertomografie und andere tomografische Verfahren (40,41). Dabei werden Organe als dreidimensionales Gesamtbild dargestellt. In der Hirnforschung können so einzelne Bereiche des menschlichen Gehirns während bestimmter Hirnleistungen bildlich dargestellt werden. Aktive Hirnzellen lassen sich identifizieren, während sich eine Versuchsperson Bilder oder Wörter einprägt oder andere Aufgaben durchführt. Diese Methode ist auch zur Untersuchung neurologischer Erkrankungen und zur Diagnose von Gehirntumoren geeignet.
Bevölkerungsstudien
Wertvolle Forschungserkenntnisse lassen sich auch mithilfe epidemiologischer Studien (Bevölkerungsstudien) gewinnen, also Untersuchungen an Gruppen von Menschen. Auf diese Weise können die Zusammenhänge zwischen bestimmten Krankheiten und dem Lebensstil sowie den Lebensumständen von Menschen, wie Ernährung, Gewohnheiten und Arbeit, aufgedeckt werden. Insbesondere die Kombination aus epidemiologischen und epigenetischen (die Art und Weise, wie Gene abgelesen werden) Analysen ist ein Forschungsfeld, das sich rasant entwickelt und sehr wertvolle Erkenntnisse für die menschliche Gesundheit liefert (42,43). Aufgrund der Ergebnisse aus epidemiologischen Untersuchungen können wichtige vorbeugende Maßnahmen abgeleitet werden. So wurden auch die krebserregenden Eigenschaften von Tabakrauch und Asbest erkannt. Fleisch- und fettreiche Ernährung, Bewegungsmangel sowie psychosoziale Faktoren konnten aufgrund von Bevölkerungsstudien als Hauptursachen für Diabetes, Krebs und Herz-Kreislauf-Erkrankungen wie Schlaganfall, Herzinfarkt und Arteriosklerose identifiziert werden.
FKS-freie Nährmedien
Der Gebrauch von FKS (fötales Kälberserum), insbesondere als Zusatz in Nährmedien für die Kultivierung von Zellen, ist immer noch sehr verbreitet. Zur Gewinnung des Blutserums wird beim Schlachtvorgang schwangeren Kühen das ungeborene Kalb herausgeschnitten. Dem noch lebenden Kalb wird eine dicke Nadel ins Herz gestochen und das Blut vollständig abgesaugt, bis das Tier durch den Blutentzug stirbt. Die Prozedur geschieht ohne Betäubung, obwohl man heute weiß, dass Föten bereits leidensfähig sind. Die Verwendung von FKS ist aus ethischen Gründen abzulehnen und birgt auch wissenschaftliche und experimentelle Nachteile.
Seit Jahren gibt es bereits tierfreie Seren für die Zellkultur, wie das humanes Blutplättchenlysat (hPL), das als „Abfallprodukt“ von Blutspenden gewonnen wird, so dass es praktisch unbegrenzt verfügbar ist (44). hPL enthält Wachstumsfaktoren und Hormone menschlichen Ursprungs, so dass für die Kultivierung menschlicher Zellen deutlich natürlichere Bedingungen in vitro geschaffen werden als in Gegenwart von FKS, in dem alle wirksamen Komponenten tierischen Ursprungs sind (Rind). Es ist vielfach gezeigt worden, dass menschliche Zellen in Kultur ihre Organ-spezifischen Eigenschaften besser ausprägen, wenn sie mit tierfreien Seren gezüchtet werden als unter Einsatz von FKS (8). Der primäre Grund, warum FKS trotz allem noch verwendet wird, ist, dass sich die Versuchsergebnisse besser mit vorangegangenen veröffentlichten Experimenten vergleichen lassen, in denen ebenfalls FKS verwendet wurde. Dies ist nötig, um die eigenen experimentellen Daten publizieren zu können. Es sind also hauptsächlich strategische Gründe und Gewohnheit, die dazu führen, dass weiterhin FKS eingesetzt wird. Dabei erfordert die Umstellung von FKS auf tierfreie Seren wie hPL einen überschaubaren Etablierungsaufwand, der in keinem Verhältnis zu den experimentellen und ethischen Vorteilen steht. Humane Organoide und ähnliche 3-dimensionale Zellkultursysteme werden in der Regel ohne FKS kultiviert, da dieses hinderlich für die Ausprägung Organ-ähnlicher Eigenschaften ist.
Die Frage nach dem richtigen Modellsystem
Klar ist: Auch die innovativen Modelle wie Organoide, MOCs und Computersimulationen haben ihre Grenzen. Klar ist aber ebenfalls: Grenzen haben Tierversuche noch mehr. Der Unterschied: Es ist sehr wahrscheinlich, dass die Limitierungen der jungen humanbasierten In-vitro- und In-silico-Technologien in den kommenden Jahren zunehmend überwunden werden, so dass menschliche Erkrankungen und die Reaktion des Körpers auf Fremdstoffe bestmöglich simuliert werden können. Aktuelle Weiterentwicklungen im Bereich der humanen Organmodelle beinhalten u.a. die Integration eines menschlichen Immunsystems, der Blutgefäße, sowie des Bindegewebes (45). Eine relevante Optimierung der Tierversuche hingegen ist nicht in Aussicht und auch nicht vorstellbar, denn es handelt sich nun mal um Forschung in einer anderen Spezies, die sich vom Menschen stark unterscheidet. Dafür haben Millionen von Jahren der Evolution gesorgt und daran wird der Mensch auch nichts ändern können, selbst wenn mittels moderner gentechnischer Verfahren wie CRISPR/Cas9 reihenweise „humanisierte Mausmodelle“ durch das Einführen menschlichen Erbguts in das tierische Genom erschaffen werden. Tierversuche gibt es seit weit über 100 Jahren und neue „Tiermodelle“ werden mit immer höherer Geschwindigkeit erschaffen. Für die Alzheimer-Forschung gibt es 188 verschiedene „Tiermodelle“ (46) - nur bezogen auf Mäuse und Ratten - und trotz allem gibt es bis heute keine wirksamen Medikamente und die Krankheit ist bei Weitem nicht aufgeklärt (16). Ineffizienter kann man sich ein Testsystem nicht vorstellen und die Erschaffung weiterer „Tiermodelle“ würde an dieser Tatsache nichts ändern.

Abb. 6: 4-Organ-Chip
Jedes Forschungsmodell hat Limitierungen, denn sonst wäre es kein Modell. Interessiert ist die Humanmedizin am Menschen und so ist der lebende Mensch selbst das einzige Forschungsobjekt, das eine ideale Vorhersagekraft liefern kann. Wer sich schon einmal genauer mit Humanstudien befasst hat, weiß jedoch: Auch ein Mensch repräsentiert nicht zuverlässig einen anderen Menschen. Wie ein Mensch individuell auf einen Wirkstoff anspricht, ist unterschiedlich und maßgeblich beeinflusst durch Geschlecht, Alter, ethnischen Hintergrund, Körperbau, allgemeinen Gesundheitszustand, Lebensweise, Ernährung sowie durch weitere Faktoren, die z.T. noch gar nicht bekannt sind. Da es selbstverständlich nicht zu verantworten ist, unbekannte Substanzen direkt in lebenden Menschen zu testen, müssen Modelle herangezogen werden, die der Testung an menschlichen Probanden vorgeschaltet ist. Es ist jedoch auch nicht zu verantworten, den menschlichen Probanden ein System voranzustellen, das eine so schlechte Vorhersagekraft hat wie die Tierversuche. Forscher und Gesetzgeber sind gefordert, die humanbasierten Methoden stärker voranzutreiben.
Abschaffung der Tierversuche: Wann und wie?
Was sich zunächst ändern muss, ist das Ungleichgewicht bei der finanziellen Förderung. Unseren Schätzungen zufolge fließen hierzulande unter 1 % der staatlichen Forschungsgelder in die Förderung tierversuchsfreier Methoden, während über 99% der Gelder in Forschungsprojekte investiert werden, die Tierversuche beinhalten (47). Dieses Ungleichgewicht gilt es zu ändern, denn wenn man ein System vorantreiben will und ein anderes zurückfahren, muss das finanzielle Gleichgewicht geändert werden. Beispielsweise ist dies in den USA der Fall, wo bis 2035 Tierversuche für Giftigkeitsprüfungen abgeschaffte werden sollen. In den nächsten Jahren wird sukzessive die finanzielle Förderung von Tierversuchen reduziert und tierversuchsfreie Verfahren verstärkt gefördert (48). Zahlreiche MOCs-Systeme werden bereits seit Langem von der FDA, der Lebensmittelüberwachungs- und Arzneimittelbehörde der USA, für gesetzlich vorgeschriebene Anwendungsbereiche umfangreich getestet (49). Auch die Niederlande haben sich zum Ziel gesetzt, Tierversuche für die Sicherheitsprüfungen von Medikamenten, Chemikalien etc. abzuschaffen, und zwar bis zum Jahr 2025 (50). Dort schreitet die Entwicklung der tierversuchsfreien Methoden ebenfalls rasant voran. Und Deutschland? Deutschland steckt fest im archaischen Dogma der Tierversuche, getrieben von Interessensvertretern, die viel Geld damit verdienen oder deren persönliche Forscherkarrieren davon abhängen. Es ist ein System, das sich selbst erhält. Damit sich daran etwas ändert, müssen Gesetzgeber und Behörden einen konkreten Plan zur Abschaffung der gesetzlich vorgeschriebenen Tierversuche ausarbeiten. Denn auch, wenn befangene Wissenschaftler der Öffentlichkeit suggerieren wollen, dass ohne Tierversuche keine menschliche Sicherheit und kein medizinischer Fortschritt möglich wäre, so häufen sich die wissenschaftlichen Belege, dass dies einfach nicht stimmt - dass es bessere Methoden gibt als den Tierversuch, und das bereits heute. Immer mehr Studien zeigen zudem auf, dass die modernen humanbasierten Forschungsmodelle nicht nur wissenschaftliche, sondern auch deutliche wirtschaftliche Vorteile gegenüber Tierversuchen haben (51, 52).
Andere Länder machen es uns vor und Deutschland sollte nicht Schlusslicht bleiben, wenn es um Zukunft und Innovation geht, nur, weil der Lobbyismus wieder einmal siegt. Auf gesetzlich vorgeschriebene Tierversuche entfallen hierzulande allerdings nur etwa ein Viertel der für Versuchszwecke eingesetzten Tiere (53). Etwa die Hälfte geht auf Kosten der Grundlagenforschung, die bekanntermaßen nicht das Ziel hat, eine biomedizinische oder sonstige Anwendung beim Menschen zu fokussieren. Diese Tierversuche abzuschaffen und tierversuchsfreie Methoden zu implementieren, wird eine schwierigere Aufgabe als im regulatorischen Sektor. Daher braucht es ein gesetzliches Verbot von Tierversuchen und effektive Anreize für akademische Wissenschaftler und insbesondere den wissenschaftlichen Nachwuchs, von den „Tiermodellen“ abzulassen und die modernen humanbasierten Verfahren zu nutzen. Diese sind mittlerweile so vielfältig, dass es für jeden Fachbereich möglich ist, geeignete tierversuchsfreie Verfahren einzusetzen - wenn denn der Wille da ist.
Fazit
Tierversuchsbefürworter behaupten gern, dass Tierversuche in der Vergangenheit für diverse medizinische Entwicklungen notwendig gewesen seien. Diese Aussage ist so nicht korrekt, denn nur, weil Tierversuche zur Erforschung verschiedener Entwicklungen durchgeführt wurden, kann kein Mensch vorhersagen, wie sich die Medizin ohne Tierversuche entwickelt hätte. Es ist sehr wahrscheinlich, dass sich ohne Tierversuche schon viel früher humanrelevantere Verfahren etabliert hätten. Vermutlich wäre die medizinische Forschung sogar schneller vorangeschritten, da sie durch die vielen falschen und widersprüchlichen Prognosen aus Tierversuchsdaten maßgeblich aufgehalten wurde und immer noch wird. Letztendlich geht es aber nicht darum, auf der Vergangenheit herumzureiten, sondern darum, in die Zukunft zu blicken. Und die zeigt ganz deutlich, dass in Anbetracht der unfassbaren Vielfalt an modernen tierversuchsfreien Technologien, die uns heute zur Verfügung stehen, der Tierversuch ein Auslaufmodell ist, das einer humanbasierten und tierleidfreien Forschung weichen muss.
21.01.2020
Dr. rer. nat. Tamara Zietek

Literatur
- Sato T et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology 2011; 41(5):1762–72
- Spence JR et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature 2011; 470(7332):105–9
- Lancaster MA et al. Cerebral organoids model human brain development and microcephaly. Nature 2013; 501(7467):373–9
- Takebe T, Wells JM. Organoids by design. Science. 2019; 364(6444):956–9
- Hartung T. Predicting toxicity of chemicals: software beats animal testing. EFSA Journal. 2019; 17(S1):e170710.
- Noorden RV. Software beats animal tests at predicting toxicity of chemicals. Nature. 2018; 559:163.
- Passini E et al. Human in silico drug trials demonstrate higher accuracy than animal models in predicting clinical pro-arrhythmic cardiotoxicity. Front Physiol. 2017; 8:668
- Hesler M et al. Non-pooled human platelet lysate: A potential serum alternative for in vitro cell culture. Altern Lab Anim. 2019; 47(3–4):116–27
- Mithal A et al. Generation of mesenchyme free intestinal organoids from human induced pluripotent stem cells. Nat Commun. 2020; 11(1):1–15
- van de Wetering M et al. Prospective derivation of a Living Organoid Biobank of colorectal cancer patients. Cell. 2015; 161(4):933–45
- Schwank G et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 2013; 13(6):653–8
- Fujii M et al. Modeling human digestive diseases with CRISPR-Cas9-modified organoids. Gastroenterology 2019; 156(3):562–76
- Clevers H. Modeling development and disease with organoids. Cell 2016; 165(7):1586–97
- Tcw J. Human iPSC application in Alzheimer’s disease and Tau-related neurodegenerative diseases. Neurosci Lett. 2019; 699:31–40
- Burbulla LF et al. Dopamine oxidation mediates mitochondrial and lysosomal dysfunction in Parkinson’s disease. Science 2017; 357(6357):1255–61
- Noh H et al. Modeling schizophrenia pathogenesis using patient-derived induced pluripotent stem cells (iPSCs). Biochim Biophys Acta. 2017; 1863(9):2382–7
- Grunwald L-M et al. Comparative characterization of human induced pluripotent stem cells (hiPSC) derived from patients with schizophrenia and autism. Transl Psychiatry. 2019; 9(1):1–11
- Victor MB et al. Striatal neurons directly converted from Huntington’s disease patient fibroblasts recapitulate age-associated disease phenotypes. Nat Neurosci. 2018; 21(3):341–52
- Veening-Griffioen DH et al. Are some animal models more equal than others? A case study on the translational value of animal models of efficacy for Alzheimer’s disease. European Journal of Pharmacology 2019; 859:172524
- Cummings JL et al. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures. Alzheimer’s Research & Therapy 2014; 6(4):37
- Cummings J. Lessons learned from Alzheimer disease: clinical trials with negative outcomes. Clin Transl Sci. 2018; 11(2):147–52
- Negraes PD et al. Modeling anorexia nervosa: transcriptional insights from human iPSC-derived neurons. Transl Psychiatry. 2017; 7(3):e1060
- Plummer S et al. A Human iPSC-derived 3D platform using primary brain cancer cells to study drug development and personalized medicine. Sci Rep. 2019; 9(1):1–11
- Halfter K, Mayer B. Bringing 3D tumor models to the clinic - predictive value for personalized medicine. Biotechnol J. 2017; 12(2)
- Tuveson D, Clevers H. Cancer modeling meets human organoid technology. Science 2019; 364(6444):952–5
- Ooft SN et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Sci Transl Med. 2019; 11(513)
- Kim M et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nat Commun. 2019; 10(1):1–15
- Mergenthaler P, Meisel A. Do stroke models model stroke? Disease Models & Mechanisms 2012; 5(6):718–25
- Dirnagl U, Fisher M. International, multicenter randomized preclinical trials in translational stroke research: it’s time to act. J Cereb Blood Flow Metab. 2012; 32(6):933–5
- Antonic A et al. Human in vitro models of ischaemic stroke: a test bed for translation. Transl Stroke Res. 2012; 3(3):306–9
- Holloway PM, Gavins FNE. Modeling ischemic stroke in vitro: the status quo and future perspectives. Stroke 2016; 47(2):561–9
- Madill M et al. In vitro and ex vivo models of multiple sclerosis. Drug Discovery Today 2016; 21(9):1504–11
- Park SE et al. Organoids-on-a-chip. Science 2019; 364(6444):960–5
- Edington CD et al. Interconnected microphysiological systems for quantitative biology and pharmacology studies. Sci Rep. 2018; 8(1):4530
- Kolanowski TJ et al. Enhanced structural maturation of human induced pluripotent stem cell-derived cardiomyocytes under a controlled microenvironment in a microfluidic system. Acta Biomater. 2020; 102:273–86
- Bauer S et al. Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model. Sci Rep. 2017; 7(1):1–11
- Rogal J et al. Stem-cell based organ-on-a-chip models for diabetes research. Advanced Drug Delivery Reviews 2019; 140:101–28
- Johnson M. Tissue chips in space: a big leap for research. NASA. 2018
- Computational Methods. EU Science Hub [aufgerufen am 09.01.2020]
- Touska P, Connor SEJ. Recent advances in MRI of the head and neck, skull base and cranial nerves: new and evolving sequences, analyses and clinical applications. Br J Radiol. 2019; 92(1104):20190513
- Aziz W et al. Emerging role of cardiac computed tomography in heart failure. ESC Heart Fail. 2019; 6(5):909-20
- Mill J, Heijmans BT. From promises to practical strategies in epigenetic epidemiology. Nat Rev Genet. 2013; 14(8):585-94
- Bakulski KM, Fallin MD. Epigenetic epidemiology: promises for public health research. Environ Mol Mutagen. 2014; 55(3):171-83
- Burnouf T et al. Human platelet lysate: Replacing fetal bovine serum as a gold standard for human cell propagation? Biomaterials 2016; 76:371-87
- Wörsdörfer P et al. Generation of complex human organoid models including vascular networks by incorporation of mesodermal progenitor cells. Sci Rep 2019; 9(1)
- Alzheimer’s Disease Research Models. ALZFORUM [aufgerufen am 09.01.2020]
- Ärzte gegen Tierversuche e.V. Forschungsförderung, 16.1.2020 (PDF) [aufgerufen am 09.01.2020]
- Ärzte gegen Tierversuche e.V. Ausstiegsplan aus dem Tierversuch, 12.9.2019 [aufgerufen am 09.01.2020]
- Fitzpatrick S, Sprando R. Advancing regulatory science through innovation: in vitro microphysiological systems. Cell Mol Gastroenterol Hepatol. 2018; 7(1):239–40
- Ärzte gegen Tierversuche e.V. Niederlande will Ausstieg aus dem Tierversuch, 31.01.2017 [aufgerufen am 09.01.2020]
- Meigs L et al. Animal testing and its alternatives – the most important omics is economics. ALTEX 2018; 35(3):275–305
- Franzen N et al. Impact of organ-on-a-chip technology on pharmaceutical R&D costs. Drug Discovery Today 2019; 24(9):1720–4
- Bundesministerium für Ernährung und Landwirtschaft (BMEL). Verwendung von Versuchstieren im Jahr 2018