Antikörper: Die Zukunft ist tierleidfrei
Obwohl leistungsfähige Methoden zur tierfreien Herstellung von Antikörpern verfügbar sind, müssen Schätzungen zufolge nach wie vor alleine in der EU jedes Jahr über 1 Million Tiere für die Antikörperherstellung sterben (1). Dies widerspricht der EU Richtlinie 2010/63/EU, die den Einsatz von Tieren nicht erlaubt, wenn andere, tierfreie Methoden zur Verfügung stehen (2). Als Reaktion auf diesen Missstand sprach sich das EU-Referenzlabor für Alternativen zu Tierversuchen (EURL ECVAM) in einer Empfehlung klar gegen den weiteren Einsatz von Tieren für die Herstellung von Antikörpern aus (1). Dieser Beitrag gibt einen Einblick in die verschiedenen Methoden zur Herstellung von Antikörpern und zeigt, warum die tierfreie Produktion von Antikörpern nicht nur für den Tierschutz, sondern auch für den Fortschritt in der Wissenschaft und Medizin – und somit für uns alle – ein Gewinn sein wird.
Ob Corona- oder Doping-Test, Krebs- oder Multiple-Sklerose-Medikamente – Antikörper sind aus Diagnostik, Therapie und Forschung nicht wegzudenken. Antikörper sind zentrale Abwehrmoleküle unseres Immunsystems. Durch passgenaue Bindung neutralisieren sie Krankheitserreger und Fremdstoffe oder markieren sie, damit sie durch Immunzellen erkannt und beseitigt werden. Somit lassen sich Antikörper in der Medizin zur Behandlung von verschiedenen Erkrankungen wie Infektionen aber auch Krebs einsetzen. Ihre passgenaue Bindung an ihr Zielmolekül, das sogenannte Antigen, wird auch in der Diagnostik und der biomedizinischen Forschung eingesetzt. Aufgrund ihrer breiten Anwendbarkeit und befeuert durch den medizinischen Fortschritt besteht ein enormer Bedarf nach immer mehr Antikörpern: Neue Krankheiten werden entdeckt, neue Virus-Varianten müssen nachgewiesen werden und neue, bessere Therapieverfahren sollen dem Menschen nutzen.
Um diesen Bedarf zu decken, wurden moderne In-vitro-Verfahren wie die Phage-Display-Technologie entwickelt, welche im Jahr 2018 mit dem Nobelpreis für Chemie ausgezeichnet wurde. Dennoch werden auch heute noch die meisten Antikörper in vivo, also im lebenden Organismus, unter Inkaufnahme des damit verbundenen Tierleids und etlicher Nachteile für Wissenschaftler und Patienten entwickelt bzw. produziert.
Herkömmliche Antikörperentwicklung: im doppelten Wortsinn inhuman
Ausgangspunkt der Entwicklung herkömmlicher, tierbasierter Antikörper ist die Ausnutzung des Immunsystems eines Tieres durch Immunisierung. Dazu wird dem Tier das Antigen, also die Substanz gegen die ein Antikörper entwickelt werden soll, mehrfach injiziert. Die Antikörper werden von bestimmten Blutkörperchen, den B-Zellen, gebildet. Dabei produzieren viele verschiedene B-Zellen jeweils einen bestimmten Antikörper, sodass die Immunantwort aus einer Mischung verschiedener Antikörper gegen das Antigen, den sogenannten polyklonalen Antikörpern, besteht. Auch heute noch werden aus Tieren gewonnene antikörperreiche Seren und die aus diesen Seren aufgereinigten polyklonalen Antikörper angewendet. Zur Herstellung Blut-basierter Produkte, zu denen sowohl Seren als auch polyklonale Antikörper gehören, wurden im Jahr 2020 in Deutschland 58.699 Tiere verwendet, davon waren 56.230 Kaninchen (3). Hauptverbraucher von Kaninchen zur Herstellung Blut-basierter Produkte in Deutschland ist unseren Recherchen zufolge die Firma Siemens Healthineers in Marburg (4).
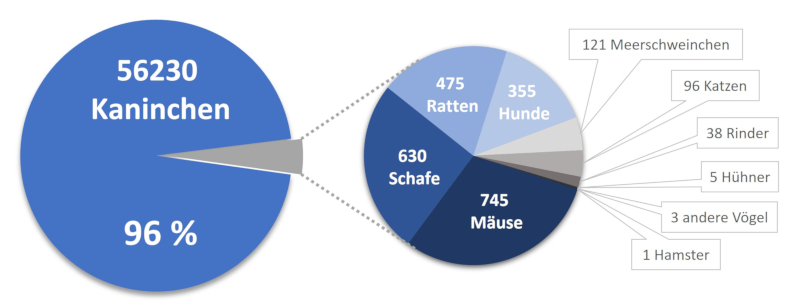
Abb. 1: Für die Herstellung Blut-basierter Produkte, zu denen Seren und polyklonale Antikörper gehören, wurden im Jahr 2020 in Deutschland 58.699 Tiere verwendet. 96 % davon waren Kaninchen. Aber auch 2.469 andere Tiere, unter ihnen vor allem Mäuse, Schafe, Ratten und Hunde, mussten für die Herstellung dieser Produkte leiden (3).
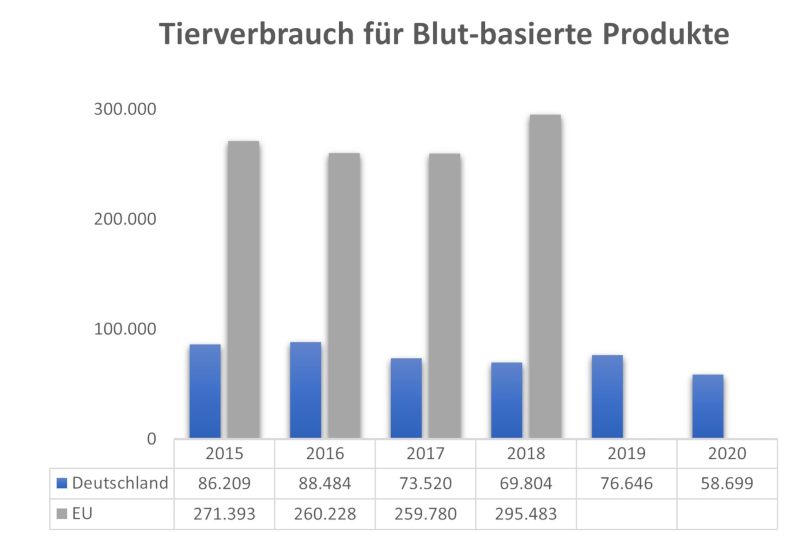
Abb. 2: In der EU wurden in den Jahren 2015 bis 2018 zwischen 260.000 und 295.000 Tiere pro Jahr zur Herstellung Blut-basierter Produkte „verbraucht“ (die Zahlen für 2019 und 2020 liegen noch nicht vor). Deutsche Tierversuchslabore haben mit einem Anteil von 23 bis 34 % wesentlich zu diesen Zahlen beigetragen.
Beispiele für so hergestellte Produkte sind das immunsuppressiv wirkende Thymoglobulin, welches in Kaninchen produziert wird, oder die gegen Schlangengifte gerichteten Antivenine, welche aus dem Blut von immunisierten Pferden gewonnen werden. Auch ein Medikament gegen Diphterie wird aus dem Blut von Pferden hergestellt (4). Neben ethischen Bedenken in Bezug auf die Verwendung von Pferden, die häufig auch noch unter erbärmlichen Bedingungen gehalten werden, stellen diese Seren auch für den Menschen ein Risiko dar. Das menschliche Immunsystem kann auf die tierischen Antikörper reagieren und so kommt es nach Verabreichung des Diphterie Antitoxins in etwa 5% der Fälle zu der lebensbedrohlichen Serum-Krankheit (5).
Ein weiteres Problem polyklonaler Antikörper ist, dass sie nicht ausschließlich an das vorgesehene Antigen binden, sondern auch an andere Moleküle mit ähnlichen Strukturelementen binden können. Dies stellt nicht nur für die therapeutische Anwendung, sondern auch für die Forschung ein Problem dar, weil es die Aussagekraft von Erkenntnissen, die unter Verwendung polyklonaler Antikörper gewonnen wurden, schmälert. Zudem sind polyklonale Antikörper - in mehr oder weniger reproduzierbarer Form - nur von einem einzigen Tier verfügbar, und selbst dabei kommt es zu chargenabhängigen Schwankungen in der Qualität. Nach dem Tod des betreffenden Tieres ist ein polyklonaler Antikörper nicht mehr in der gleichen Komposition erhältlich. Sofern sich die Wissenschaftler dieser Problematik überhaupt bewusst sind, führt dies dazu, dass jede Charge eines polyklonalen Antikörpers aufwändig getestet und validiert werden muss. Anderenfalls ist es fraglich, ob sich die gewonnenen und publizierten Ergebnisse später reproduzieren lassen (6).
Im Gegensatz zu polyklonalen Antikörpern binden monoklonale Antikörper an ein einzelnes, exakt definiertes Strukturelement des Antigens. Monoklonale Antikörper werden von einzelnen B-Zellen produziert. Um an diese Zellen zu gelangen, wird einem Tier, meist einer Maus, wiederholt das Antigen gespritzt. Dann wird das Tier getötet und seine Milz entnommen. Aus der Milz werden B-Lymphozyten isoliert. Jede dieser Zellen produziert einen einzigen monoklonalen Antikörper. Aus der Vielzahl der aus der Milz gewonnenen B-Lymphozyten werden in einem Screening-Verfahren die Zellen identifiziert, welche einen Antikörper mit den gewünschten Eigenschaften produzieren. Um die monoklonalen Antikörper dauerhaft verfügbar zu machen, können die Milzzellen mit Krebszellen fusioniert werden. Die aus dieser Verschmelzung hervorgehenden Hybridomzellen enthalten die aus der Milzzelle stammende genetische Information für die Bildung eines monoklonalen Antikörpers und kombinieren sie mit der unbegrenzten Teilungsfähigkeit der Krebszelle (7). Ist so eine Hybridomzelle etabliert, kann sie beliebig lange in Kultur gehalten werden und gibt den von ihr produzierten Antikörper in den Zellkulturüberstand ab. Zumindest in der Anfangsphase der Kultivierung wird den Zellkulturmedien häufig fötales Kälberserum zugesetzt, welches bei der Schlachtung von schwangeren Kühen aus dem noch schlagenden Herzen des Kalbs gewonnen wird (8). Das Kälberserum kann jedoch ersetzt werden durch humanes Thrombozytenlysat, welches aus nicht genutzten Bestandteilen von Blutspenden gewonnen wird (9).
Die Kultivierung der Hybridomzellen kann abhängig von der benötigten Menge des Antikörpers in verschiedenen Maßstäben erfolgen, in kleinen Reaktionsgefäßen, in größeren Flaschen oder in Bioreaktoren, die in unterschiedlichsten Maßstäben bis mehrere 1.000 Liter erhältlich sind. Die Herstellung des Antikörpers ist im Bioreaktor unter exakt definierten und reproduzierbaren Bedingungen möglich. Antikörper, die unter solchen Bedingungen hergestellt werden, weisen eine gleichbleibend hohe Qualität auf.
Mäuse werden in der Antikörperproduktion als lebende Bioreaktoren missbraucht
Obwohl also monoklonale Antikörper in vitro, also in Zellkultur, in gut skalierbaren Bioreaktoren produziert werden können, werden auch heute noch Antikörper mit der extrem grausamen Aszites-Methode hergestellt (siehe auch Tabelle 1). Dafür wird Mäusen zunächst ein Mineralöl in die Bauchhöhle gespritzt, wodurch es zu einer Reizung des Bauchfells kommt. Im Anschluss werden Hybridomzellen in die Bauchhöhle der Mäuse eingebracht. Die Hybridomzellen vermehren sich im Bauchraum der Tiere unkontrolliert und bilden einen Tumor, welcher große Mengen des monoklonalen Antikörpers produziert und in die Aszitesflüssigkeit abgibt. Diese Flüssigkeit wird durch Stich mit einer Kanüle in die Bauchhöhle gewonnen. Diese sogenannte Punktierung kann für 2 bis 3 Wochen ca. zweimal pro Woche erfolgen. Von manchen Experimentatoren wird dafür der verharmlosende Begriff „Melken“ verwendet (10), der dem hochbelastenden Tierversuch in keiner Weise gerecht wird. Danach ist der Tumor so weit gewachsen, dass die Tiere getötet werden müssen.
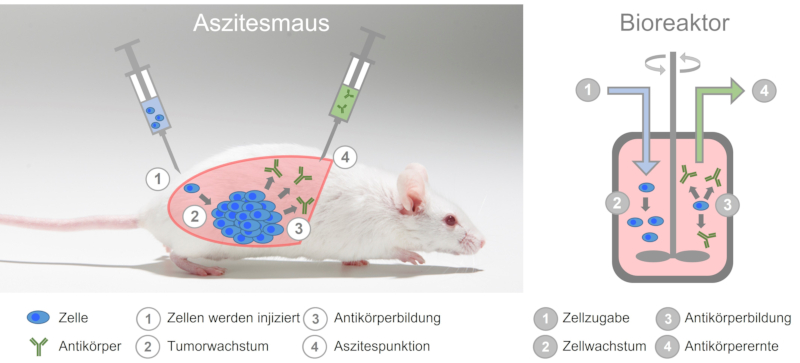
Abb. 3: Bei der Aszites-Methode werden Mäuse als lebende Bioreaktoren missbraucht.
Die Tiere sind bei dem Versuch einer großen Schmerzbelastung ausgesetzt (11). Bereits im Jahr 1998 stellte das ECVAM fest, dass es zur Herstellung von Antikörpern In-vitro-Methoden gibt, die dem Aszites-Verfahren ebenbürtig oder ihm sogar überlegen sind und deshalb der Einsatz des Aszites-Verfahrens auf wenige wohl zu begründende Ausnahmen beschränkt werden sollte (12). Dennoch wurden im Jahr 2019 alleine in Deutschland 1.456 Mäuse zur Herstellung von monoklonalen Antikörpern mit der Aszites-Methode eingesetzt (13), und auch im Jahr 2020 wurden 1.050 Mäuse zur Herstellung monoklonaler Antikörper verwendet (3).
Humanisierung von Antikörpern: Der lange Weg vom Tier zum Patienten
Unabhängig von ihrer Produktion in vivo oder in vitro werden auch monoklonale Antikörper tierischen Ursprungs vom menschlichen Immunsystem als fremd erkannt. Um dies zu verhindern, werden monoklonale Antikörper für therapeutische Anwendungen in einem aufwändigen Prozess humanisiert, also dem menschlichen Antikörper ähnlicher gemacht. Dazu wird das konstante Grundgerüst der tierischen Antikörper, das nicht an der Bindung an das Antigen beteiligt ist, gentechnisch durch die entsprechenden humanen Bereiche ersetzt. Die genetische Information zur Produktion der humanisierten monoklonalen Antikörper wird dann in sogenannte Produktionszelllinien eingeschleust, sodass der Antikörper von ihnen hergestellt und an das Zellkulturmedium abgegeben wird. Die meisten Produktionszelllinien sind ebenfalls tierischen Ursprungs. So wurde die am häufigsten für die Antikörperproduktion eingesetzte CHO (Chinese Hamster Ovary) Zelllinie aus dem Eierstock eines Chinesischen Zwerghamsters gewonnen. Auch wenn in diese Zellen die genetische Information zur Produktion humanisierter Antikörper eingeschleust wird und die so produzierten Antikörper also aus dem humanen Grundgerüst bestehen, unterscheiden sie sich dennoch von denen, die das menschliche Immunsystem herstellt. Neben den miteinander verknüpften Aminosäuren enthält ein Antikörper auch Zuckerreste. Diese werden von der Zelle nach dem Ablesen der genetischen Information und der Herstellung der entsprechenden Aminosäuresequenz an dem Antikörper angebracht.
Somit sind in tierischen Zellen produzierte humanisierte Antikörper mit für die jeweilige Tierart spezifischen Zuckerresten versehen, welche sich in ihrem Aufbau, dem sogenannten Glykosylierungsmuster, von denen des Menschen unterscheiden (14). Diese Unterschiede können wiederum dazu führen, dass das menschliche Immunsystem die Antikörper als fremd erkennt und bekämpft. So führte beispielsweise die Verabreichung von Cetuximab, eines in tierischen Zellen hergestellten Antikörpers zur Behandlung von Darmkrebs, bei Patienten zu Immunreaktionen, die bis zur Anaphylaxie reichten, einer potenziell lebensbedrohlichen allergischen Reaktion (15). Die Immunreaktionen wurden auf einen Zuckerrest des Antikörpers zurückgeführt, der aus der tierischen Produktionszelllinie stammt (16). Um dies zu verhindern, wurde eine Reihe von humanen Produktionszelllinien entwickelt. In diesen kann der Antikörper mit dem passenden humanen Glykosylierungsmuster hergestellt werden (14).
Antikörper lassen sich auch menschlich und human herstellen
Es scheint nicht nur grausam, sondern auch furchtbar umständlich, Antikörper vom Immunsystem von Tieren produzieren zu lassen, das Tier zu töten, dann die B-Zellen aus den Tieren zu isolieren und die den tierischen Antikörpern zugrundeliegende genetische Information zunächst zu bestimmen und dann gentechnisch zu humanisieren, um sie dann in Produktionszellen einzufügen, die – sofern sie nicht humanen Ursprungs sind – wiederum zu Abweichungen vom durch das menschliche Immunsystem produzierten Antikörper führen. Und tatsächlich geht es auch einfacher. Statt den mühevollen Umweg über das Tier zu gehen, lassen sich Antikörper auch vollständig tierfrei und human entwickeln.
Die am weitesten verbreitete Methode zur Entwicklung tierfreier Antikörper ist die Phage-Display-Technologie (17). Dafür werden B-Zellen bspw. aus dem Blut eines Spenders isoliert und die genetische Information zur Herstellung der Antigen-bindenden Bereiche der Antikörper gewonnen. Diese genetische Information wird in das Genom von Phagen, das sind Viren die Bakterien befallen, eingebaut. Die Phagen produzieren in der Folge Antikörperfragmente und heften sie an ihrer Oberfläche an. So sind sogenannte Bibliotheken von Phagen zugänglich, von denen jeder Phage ein anderes Antikörperfragment auf seiner Hülle präsentiert und gleichzeitig die genetische Information zur Herstellung dieses Antikörperfragments enthält. Aus diesen Bibliotheken können nun gezielt die Antikörperfragmente herausgesucht werden, die an ein gewünschtes Antigen binden.
Vergleich menschliches Immunsystem und Phage-Display
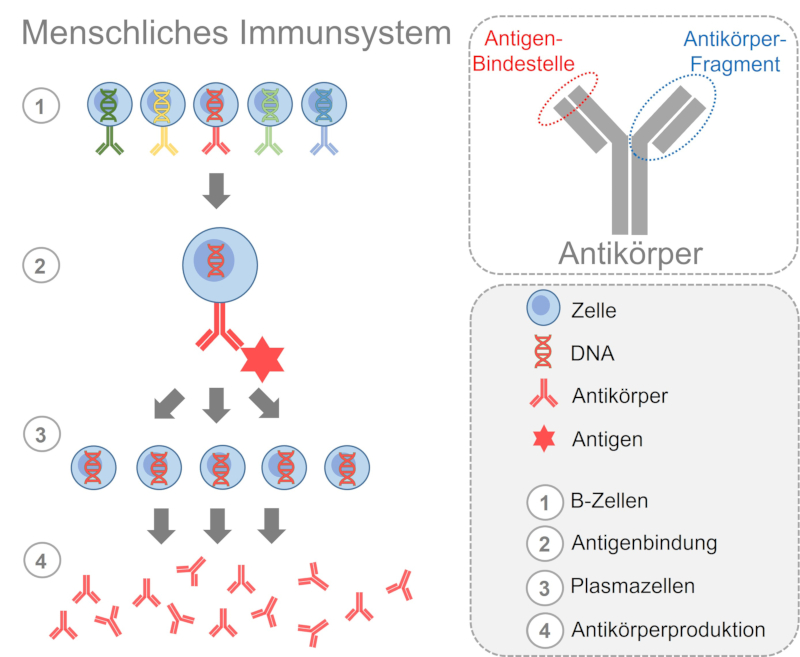
Abb. 4: Humane B-Zellen präsentieren an ihrer Oberfläche verschiedene Antikörper. Bei Kontakt zum Antigen entstehen aus den B-Zellen mit passendem Antikörper Plasmazellen. Die Plasmazellen produzieren den Antikörper.
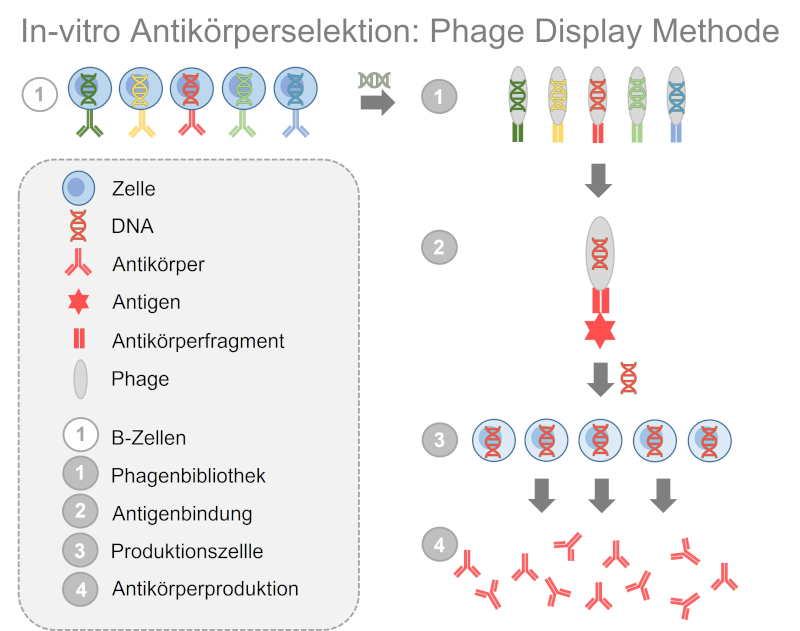
Abb. 5: Bei der Phage-Display-Technologie wird DNA aus B-Zellen gewonnen, in Phagen übertragen und so ein menschliches Immunsystem nachgeahmt. Die Phagen tragen daraufhin Antikörperfragmente auf ihrer Oberfläche. Durch Zugabe des Antigens werden Phagen mit passenden Antikörperfragmenten ausgewählt. Die DNA zur Produktion des Antikörperfragments wird anschließend in Produktionszellen übertragen.
Bei diesem Selektionsprozess können die Antikörper bereits an die spätere Anwendung angepasst werden (siehe auch Tabelle 2). So kann zum Beispiel die Spezifität gelenkt werden, indem Gegenselektionen eingeführt werden, bei denen Antikörperfragmente, die an Strukturen binden die dem Antigen ähnlich sind, entfernt werden. Zudem ist es möglich, bereits „vorgeprägte“ Antikörperbibliotheken zu gewinnen. So wurden bspw. genesene COVID-19-Patienten als Spender für die Entwicklung einer Phagen-Bibliothek verwendet, um Antikörper für die Therapie von COVID-19 zu erhalten (18).
Insbesondere im therapeutischen Bereich wurden bereits etliche mittels Phage-Display entwickelte Antikörper zugelassen und viele weitere befinden sich in der klinischen Prüfung (19). Ein Beispiel dafür ist Humira, ein Medikament, welches zur Behandlung der rheumatoiden Arthritis eingesetzt wird und mit dem der Pharmakonzern AbbVie im Jahr 2021 über 20 Milliarden US-Dollar Umsatz gemacht hat (20). Während sich in der therapeutischen Anwendung die Phage-Display-Methode also bereits etabliert, bestehen insbesondere in der biomedizinischen Forschung Widerstände gegen den Ausstieg aus der tierbasierten Antikörperentwicklung.
Aptamere als tierleidfreier Ersatz für Antikörper
Alle in diesem Beitrag bisher vorgestellten Methoden hängen direkt oder indirekt von einem Immunsystem ab und resultieren in Antikörpern als Produkte von Zellen. Es gibt auch Alternativen zu Antikörpern, die gänzlich tier- und zellfrei hergestellt werden können. Ein Beispiel dafür sind die sogenannten Aptamere.
Aptamere bestehen im Gegensatz zu Antikörpern nicht aus Aminosäuren, sondern aus den Grundbausteinen der DNA. Anders als die DNA, die wir aus dem Erbgut kennen, falten sich Aptamere nicht in die bekannte Doppelhelix, sondern in komplexe dreidimensionale Strukturen. Diese Strukturen ermöglichen die passgenaue Bindung an ein gewünschtes Molekül, welche vergleichbar ist mit der Bindung zwischen einem Antikörper und seinem Antigen.
Aptamere werden aus künstlich hergestellten DNA-Bibliotheken in einem als SELEX (Systematische Evolution von Liganden durch exponentielle Anreicherung) bezeichneten In-vitro-Verfahren entwickelt (21). Die Bibliotheken bestehen aus Oligonukleotiden, in deren Kernbereich die 4 Grundbausteine der DNA, die sogenannten Nukleobasen, in zufälliger Anordnung aneinandergereiht sind. Dadurch erhalten die Bibliotheken eine außerordentliche Vielfalt individueller Sequenzen: Bei einer Anzahl von 40 zufällig aneinandergereihten Nukleobasen sind theoretisch 440 individuelle, unterschiedliche Sequenzen möglich. Das sind eine Quadrillion (1024) oder ausgeschrieben 1.000.000.000.000.000.000.000.000 unterschiedliche DNA Moleküle. Im Vergleich dazu wird geschätzt, dass das menschliche Immunsystem über ein Repertoire von „nur“ einer Trillion (1018) unterschiedlichen Antikörpern verfügt (22), also ein Millionstel der Diversität der DNA-Bibliotheken.
Jede einzelne DNA-Sequenz der Bibliothek faltet sich in eine eigene 3D-Struktur. Um nun Aptamere zu erhalten, die an ein gewünschtes Zielmolekül binden, wird die Bibliothek mit diesem Zielmolekül in Kontakt gebracht. Die Sequenzen, die an das Zielmolekül binden, werden isoliert und mittels Polymerasekettenreaktion (PCR) vervielfältigt. Das Resultat ist eine Mischung verschiedener Oligonukleotide, die bereits eine gewisse Affinität für das Zielmolekül haben. Diese Mischung wird wiederum mit dem Zielmolekül in Kontakt gebracht, wobei die einzelnen Sequenzen um die Bindung an die Zielstruktur konkurrieren und sich die Sequenzen mit den besseren Bindungseigenschaften durchsetzen. Dieser Prozess wird mehrfach wiederholt, bis Sequenzen mit der gewünschten Affinität erhalten werden. Nach der letzten Selektionsrunde werden die erhaltenen Aptamere sequenziert und lassen sich dann rein chemisch herstellen. Ebenso wie beim Phage-Display-Verfahren, können auch bei der SELEX Gegenselektionen durchgeführt werden, um die Spezifität der Aptamere gezielt zu beeinflussen.
Die erhaltenen Aptamere können über ähnliche Affinitäten verfügen wie Antikörper oder ihnen sogar überlegen sein. Ein wesentlicher Vorteil ist, dass sich Aptamere im Gegensatz zu Antikörpern synthetisch mittels Festphasensynthese herstellen lassen. Da Aptamere vollständig ohne Tiere, Zellen und tierische Produkte hergestellt werden, wird eine Kontamination der Aptamere mit Viren oder potenziell immunogenen Substanzen, die aus tierischen Organismen oder der Zellkultur stammen, vollständig vermieden. Dies ist insbesondere für therapeutische Anwendungen ein Vorteil. Ein Aptamer wurde 2004 für die Behandlung der feuchten altersabhängigen Makuladegeneration, einer Erkrankung des Auges, zugelassen. Weitere Aptamere befinden sich in der klinischen Prüfung (23).
Woher kommen die Widerstände gegen tierfreie Antikörper und ihre Alternativen?
Antikörper, die im Tier gewonnen wurden, führen zu den bereits beschriebenen Spezifitätsproblemen, welche den Erkenntnisgewinn gefährden und zu Chargenschwankungen, die ihren reproduzierbaren Einsatz behindern. Viele Wissenschaftler scheinen sich mit diesen Mängeln abgefunden zu haben oder nehmen sie als generelle Probleme von Antikörpern wahr. Sie sind sich der neuen Techniken wie der Phage-Display-Technologie oder der Möglichkeiten zum Ersatz von Antikörpern durch Aptamere nicht bewusst, oder unterschätzen die Leistungsfähigkeit dieser Methoden und beharren weiter auf althergebrachten Prozessen. So ist es auch der Innovationsfeindlichkeit der Forschenden geschuldet, dass selbst so grausame Verfahren wie die Aszites-Methode noch immer angewandt werden. Für viele Experimentatoren ist die Haltung von Tieren einfacher als das Erlernen und die Verwendung moderner In-vitro-Methoden. In der grausamen Konsequenz werden Mäuse als lebende und fühlende Bioreaktoren für die Antikörperherstellung missbraucht. Nicht weil es keine tierfreien Methoden gibt, sondern weil es bequemer ist, die bereits etablierte tierbasierte Methode beizubehalten, als auf moderne und tierfreie Methoden umzustellen. Zudem besteht aus Perspektive vieler Forschender kein Handlungsbedarf, da tierbasierte Forschung noch immer – meist unter Verwendung von Steuergeldern – gefördert wird und sich in renommierten Zeitschriften veröffentlich lässt. Und das obwohl die EU-Tierversuchsrichtlinie 2010/63/EU Tierversuche eigentlich verbietet, wenn gleichwertige tierversuchsfreie Methoden verfügbar sind (2).
Wie kann der Ausstieg aus tierbasierten Antikörpern gelingen?
Das EU-Referenzlabor für Alternativen zu Tierversuchen (EURL ECVAM) weist in seiner Empfehlung ausdrücklich darauf hin, dass mit der Phage-Display-Technologie eine valide Methode zur tierfreien Entwicklung von Antikörpern zur Verfügung steht und Projekte, die Tiere zur Antikörper-Entwicklung einsetzen, daher durch die Genehmigungsbehörden abgelehnt werden sollten. Die Produktion von Antikörpern mit der Aszites-Methode sollte unter keinen Umständen mehr gestattet werden. Um den zeitnahen Ausstieg aus tierbasierten Antikörpern voranzutreiben und die zuvor skizzierten Widerstände zu brechen, hat das ECVAM eine Reihe von Maßnahmen formuliert (1).
So werden Förderinstitutionen, die Forschungsprojekte mit öffentlichen oder privaten Mitteln finanzieren, vom ECVAM aufgefordert, keine Projekte mehr zu unterstützen, die eine Entwicklung von tierischen Antikörpern beinhalten. Zudem sollen die Förderinstitutionen die Entwicklung hin zu einer Forschung ohne tierische Antikörper durch entsprechende Verteilung der Fördergelder vorantreiben. Auch die Wissenschaftler selbst werden vom ECVAM angesprochen. Sie sollen zur Verfolgung ihrer Forschungsziele bevorzugt tierfreie Antikörper verwenden und akademische Institutionen sollen entsprechende tierfreie Methoden etablieren.
Hersteller von Antikörpern und ihre Vertriebspartner werden aufgefordert, tierische Antikörper in ihren Katalogen durch tierfreie Antikörper zu ersetzen, zudem sollen sie konkrete Pläne für einen zügigen Ausstieg aus der tierbasierten Produktion von Antikörpern erstellen und verfolgen.
Schließlich richtet sich das ECVAM auch an Verlage, Editoren und Gutachter, die aufgefordert werden, darauf hinzuwirken, dass in Veröffentlichungen die Quellen von Antikörpern klar beschrieben werden müssen. Arbeiten, in denen tierische Antikörper verwendet wurden, obwohl tierfreie Alternativen zur Verfügung stehen, sollten nicht mehr veröffentlicht werden.
Somit adressiert das ECVAM alle relevanten Akteure und empfiehlt einen Katalog von Maßnahmen, damit Arbeiten, die tierische Antikörper beinhalten, in Zukunft nicht mehr genehmigt, gefördert und veröffentlicht werden. Wir werden uns weiterhin dafür stark machen, dass Genehmigungsbehörden, Geldgeber und Verlage diesen Empfehlungen Gehör schenken.
Fazit
Der Umweg über ein tierisches Immunsystem bei der Herstellung von Antikörpern für humane Anwendungen ist mühselig, unnötig und vor allem auch risikobehaftet, da sich die Antikörper von Mensch und Tier stark unterscheiden. Mit modernen mit dem Nobelpreis ausgezeichneten Display-Verfahren lässt sich ein humanes Immunsystem in vitro nachahmen, und die Verwendung humaner Produktionszelllinien in modernen Bioreaktoren führt im doppelten Wortsinn zu humanen Antikörpern, welche sich therapeutisch zum Nutzen des Menschen und unter Vermeidung schwerer Nebenwirkungen einsetzen lassen und kein Tierleid verursachen. Somit ist der qualvolle Einsatz von Tieren zur Herstellung von Antikörpern nicht nur ethisch nicht zu vertreten, sondern widerspricht auch der EU-Richtlinie, nach der ein Einsatz von Tieren nur dann gerechtfertigt ist, wenn es keine tierfreien Alternativen gibt. Zudem verfügen tierfrei produzierte Antikörper über herausragende Eigenschaften, die in der Forschung dringend benötigt werden.
Das Beharren auf tierbasierten Antikörpern ist nicht zeitgemäß, behindert den wissenschaftlichen und medizinischen Fortschritt und schadet somit nicht nur den Tieren, die dafür ihr Leben lassen müssen, sondern uns allen.
16. Juni 2022
Dr. Johanna Walter

Quellen
- Barroso, J. et al. EURL ECVAM Recommendation on non-animal-derived antibodies; Publications office of the European Union, 2020
- Richtlinie 2010/63/EU des europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere
- Bericht des BfR vom 16.12.2021: Zahlen zu den im Jahr 2020 verwendeten Versuchstieren
- Wenzel, E.V. et al. Human antibodies neutralizing diphtheria toxin in vitro and in vivo. Sci. Rep. 2020, 10 (1), 571
- Kupferschmidt, K. Scientists find way to make diphtheria treatment without injecting horses with toxin. Science 2020
- Goodman, Simon. L. The antibody horror show: an introductory guide for the perplexed. New Biotechnol. 2018, 45, 9–13
- Köhler, G. & Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975, 256 (5517), 495–497
- Schulz, J. Stellungnahme Fetales Kälberserum. 28.08.2017 >>
- Kirsch, H.M. Nachhaltige in vitro Kultivierungsansätze in der Zellkulturtechnik: Xenofreie Kultivierungsoptimierung mit Thrombozytenlysat. Dissertation, Leibniz Universität Hannover, 2021
- Richtlinie ‚Herstellung von Monoklonalen Antikörpern 5.01‘, Bundesamt für Lebensmittelsicherheit und Veterinärwesen BLV, Schweiz, Juli 2017
- Fischer, R. W. & Ferber, P. C. Monoclonal antibodies comparative methods for in vitro production. ALTEX - Altern. Anim. Exp. 1992, 9 (1), 15–24
- ECVAM statement on the scientific acceptability and practical availability of in vitro methods for the production of monoclonal antibodies. 14. Mai 1998
- BMEL 8.12.2020: Versuchstierdaten 2019
- Fliedl, L. et al. Human cell lines for the production of recombinant proteins: on the horizon. New Biotechnol. 2015, 32 (6), 673–679
- Fischer, J. et al. Alpha-Gal-Syndrom: Ein Überblick zum klinischen Bild und zu pathophysiologischen Konzepten. Hautarzt 2022, 73 (3), 195–200
- Chung, C.H. et al. Cetuximab-induced anaphylaxis and IgE specific for galactose-α-1,3-galactose. N. Engl. J. Med. 2008, 358 (11), 1109–1117
- Jaag, H.M. Antikörper aus Phagen, 7.1.2014 >>
- Dübel, S. et al. COR-101, ein menschlicher Antikörper gegen COVID-19. BIOspektrum 2021, 27 (1), 46–48
- Frenzel, A. et al. Designing human antibodies by phage display. Transfus. Med. Hemotherapy 2017, 44 (5), 312–318
- Statista: Umsatz des Pharmaunternehmens AbbVie mit dem Arzneimittel Humira in den Jahren 2011 bis 2022 >>
- Zhuo, Z. et al. Recent advances in SELEX technology and aptamer applications in biomedicine. Int. J. Mol. Sci. 2017, 18 (10), 2142
- Briney, B. et al. Commonality despite exceptional diversity in the baseline human antibody repertoire. Nature 2019, 566 (7744), 393–397
- Li, Z. et al. Advances in screening and development of therapeutic aptamers against cancer cells. Front. Cell Dev. Biol. 2021, 9, 662791
