Endometriose: Tierversuche und tierversuchsfreie Forschung
Endometriose ist eine der häufigsten Unterleibserkrankungen bei Frauen, wobei sich die Erkrankung nicht auf das Fortpflanzungssystem beschränkt. Bei Endometriose kommt es zu einer Ansiedlung von der Gebärmutterschleimhaut ähnelndem Gewebe außerhalb der Gebärmutter (Uterus). Die Erkrankung geht mit erheblichen Schmerzen und einer Verminderung der Lebensqualität einher und kann zu einer ungewollten Kinderlosigkeit führen. Bisher konnte die überwiegend tierexperimentell ausgerichtete Endometrioseforschung weder die Ursachen der Erkrankung aufklären noch eine Heilung ermöglichen und auch die Wirksamkeit der bestehenden Therapien ist begrenzt. Dieser Beitrag erklärt die Hintergründe für dieses Scheitern und zeigt wie Endometrioseforschung tierfrei gelingen kann.
Die Erkrankung
Bei Endometriose befindet sich an Gebärmutterschleimhaut, das sogenannte Endometrium, erinnerndes Gewebe außerhalb der Gebärmutter. Das Gewebe findet sich häufig im Bauchraum, kann aber auch in weiter entfernten Organen gefunden werden. Die Erkrankung verursacht chronische Bauchschmerzen sowie schmerzhafte Regelblutungen und hat häufig einen unerfüllten Kinderwunsch zur Folge. Es kann auch zu blutgefüllten Zysten im Eierstock, den sogenannten Endometriomen kommen. Es wird geschätzt, dass 2 bis 20 % der Frauen – auch ohne entsprechende Symptome - die Erkrankung haben. Bei den Frauen, die unter einer schmerzhaften Menstruation leiden, sind sogar 40 bis 60 % betroffen und bei Frauen, die Schwierigkeiten haben, schwanger zu werden, 20 bis 30 % (1).
Die Ursachen der Erkrankung sind noch nicht vollständig geklärt. Die Theorie der retrograden Menstruation geht davon aus, dass ein Teil des Menstruationsblutes nicht nach außen abfließt, sondern durch die Eileiter in die Bauchhöhle gelangt. Das Blut enthält auch Gebärmutterschleimhautzellen, welche sich in der Bauchhöhle ansiedeln und aus denen die Endometrioseherde entstehen sollen. Es gibt jedoch auch seltene Fälle, in denen Organe wie die Lungen oder das Gehirn von Endometriose betroffen sind, was sich durch die Theorie der retrograden Menstruation nicht erklären lässt. Hier wird diskutiert, ob die Endometriose an Ort und Stelle entstehen kann, indem sich Zellen des entsprechenden Organs in Gebärmutterschleimhautzellen differenzieren. Diese Theorie könnte auch erklären, wie in seltenen Fällen auch Männer oder Mädchen vor dem Eintreten der Pubertät erkranken können (2). Aufgrund einer familiären Häufung der Endometriose wird auch eine genetische Ursache vermutet (3).
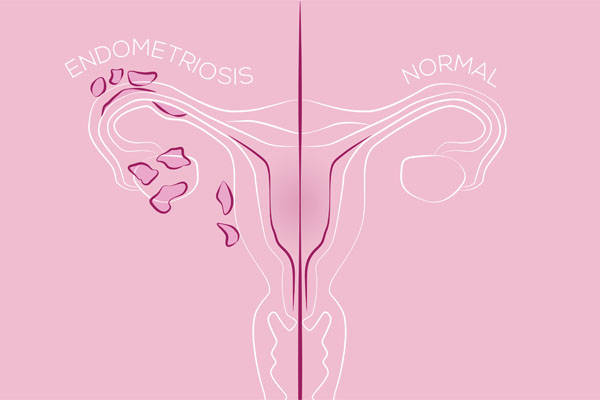
Die Grafik zeigt, wie sich Gebärmutterschleimhaut-ähnliches Gewebe außerhalb des Uterus ansiedelt.
Grafik: Adobestock_Yatakviju
Die Behandlungsmöglichkeiten
Für die Behandlung einer Endometriose stehen Schmerzmittel, Hormone und eine Operation zur Verfügung. Gelbkörperhormone (Gestagene) werden eingesetzt, um den Eisprung und die Menstruation zu unterdrücken. Dadurch können die im Körper versprengten Endometrioseherde ruhiggestellt oder Symptome gemildert werden. Eine Heilung tritt allerdings nicht ein und nach dem Absetzen der Hormone treten die Symptome erneut auf. Für Frauen, die ihre Familienplanung noch nicht abgeschlossen haben, kommt eine dauerhafte Therapie mit Hormonen nicht in Frage. Zudem weisen Hormone eine Reihe von Nebenwirkungen auf wie Gewichtszunahme, Wassereinlagerungen, Kopfschmerzen oder Stimmungsschwankungen. Auch eine Behandlung mit Medikamenten, die die körpereigene Produktion der weiblichen Geschlechtshormone hemmen, findet bei Endometriose Anwendung. Dadurch kommt es jedoch zu unangenehmen Wechseljahrs-Beschwerden.
Bei der operativen Entfernung von Endometrioseherden werden diese entweder chirurgisch entfernt oder mit Hitze verödet. Es gibt nur wenig aussagekräftige Studien darüber, wie hoch die Erfolgsrate dieser Maßnahmen ist und bei welchem Anteil der operierten Frauen erneut Endometrioseherde auftreten (4). Der Erfolg ist unter anderem davon abhängig, ob eine vollständige Entfernung der Herde gelingt. Häufig wird die Operation mit einer medikamentösen Therapie kombiniert, in der Hoffnung, dadurch das Risiko der Bildung neuer Herde zu verringern. Eine Entfernung der Gebärmutter erfolgt nur in Ausnahmefällen, wenn beispielsweise Endometriose-Herde in der Muskelwand der Gebärmutter vorkommen. Die Operation kann zur Besserung der Symptome führen, führt jedoch nicht notwendigerweise zur Heilung.
Entwicklung neuer Behandlungsmöglichkeiten
Es befindet sich derzeit zwar eine ganze Reihe von neuen Medikamenten in der Entwicklung, doch die meisten zielen wiederum auf die Hormone ab und die wenigen Medikamente mit anderem Wirkmechanismus sind noch nicht umfassend untersucht (5).
Die meisten Wirkstoffe scheitern dabei in der Phase II der klinischen Studien, also genau dann, wenn sie erstmals an Patienten getestet werden (6). Da die Sicherheit der Substanzen, die Phase II erreichen, bereits in Phase I an gesunden Teilnehmern untersucht wurde, legt dies den Verdacht nahe, dass das spätere Scheitern in Phase II in einem Mangel an Wirksamkeit begründet ist. Als Ursache dafür wird vermutet, dass die menschliche Erkrankung und die Natur und Entstehung des Endometriosegewebes zu wenig verstanden ist (6).
Zusammenfassend konnten in den letzten Jahrzehnten keine neuartigen Therapiekonzepte entwickelt werden, was vor allem daran liegt, dass die Erkrankung bis heute nicht verstanden ist (5). Dies ist wiederum wesentlich auf die verwendeten tierexperimentellen Modelle zurückzuführen, welche keinen Einblick in die menschliche Erkrankung ermöglichen.
Die „Tiermodelle“
Endometriose kommt nur bei Menschen und einigen nicht-menschlichen Primaten vor. Nicht-menschliche Primaten wurden daher in großem Umfang zur Untersuchung der Erkrankung eingesetzt (7).
Primaten in der Endometrioseforschung
Einige nicht-menschliche Primaten zeigen ähnlich wie der Mensch einen Menstruationszyklus. Diese Tierarten können spontan Endometriose entwickeln. Für 11 Affenspezies wurde von einem spontanen Auftreten von Endometriose berichtet, allerdings werden hauptsächlich Rhesusaffen und Paviane in der Erforschung der Erkrankung eingesetzt (1,7). Die Häufigkeit von natürlich vorkommender Endometriose beträgt bei Pavianen zwischen 12 und 17 % (8).
Da sich Endometriose langsam über einen Zeitraum von mehreren Jahren ausbildet, wurden Methoden entwickelt, um die Erkrankung künstlich hervorzurufen. So wird bei Primaten der Menstruationsfluss in den Bauchraum umgeleitet, indem der Gebärmutterhals verlegt oder verschlossen wird, um die Menge der retrograden Menstruation zu erhöhen. Darüber hinaus kann die chirurgische Induktion der Erkrankung durch das Vernähen von Fragmenten von Gebärmutterschleimhautgewebe an ektopischen (untypischen) Stellen oder durch das Besiedeln der Bauchhöhle mit Fragmenten von Endometriumgewebe erfolgen (7).
Die künstlich verursachte Endometriose bei Primaten unterscheidet sich jedoch fundamental von der spontan entwickelten Erkrankung. Sie fußt auf der Theorie der retrograden Menstruation, die jedoch nicht alle Endometriosefälle erklärt und somit nicht die alleinige Ursache der Erkrankung sein kann. Auch die spontan entwickelte Endometriose verläuft bei nicht-menschlichen Primaten anders als bei Menschen, so kommt es kaum zu schwereren Krankheitsverläufen mit einem Befall der Eierstöcke (1).
Neben ethischen Bedenken bei der Verwendung von Primaten sind es vor allem die hohen Kosten, die einen breiten Einsatz in der Endometrioseforschung verhindern. Aus diesem Grund wurden kleinere Versuchstiere, insbesondere Nagetiere, zur Entwicklung sogenannter Tiermodelle der Endometriose eingesetzt.
Nagetiere in der Endometrioseforschung
Bei Nagetieren kommt Endometriose nicht natürlich vor und muss daher künstlich hervorgerufen werden. Dazu wird Gebärmutterschleimhaut in die Bauchhöhle der Tiere implantiert. Je nachdem, ob dabei menschliches Gewebe oder solches aus der Maus verwendet wird, unterscheidet man zwischen heterologen und homologen Endometriose“modellen“.
Heterologe Xenograft-Modelle
Beim sogenannten heterologen Xenograft-Modell wird menschliches Endometriosegewebe Mäusen in die Bauchhöhle oder unter die Haut implantiert. Da das Immunsystem der Tiere das fremde Gewebe erkennen und attackieren würde, werden dazu immundefiziente Mäuse eingesetzt, bei denen meist durch Genmanipulation ein geschwächtes Immunsystem hervorgerufen wird. Den Tieren werden zudem die Eierstöcke entfernt und durch Gabe von Hormonen wird versucht, den 28 Tage dauernden menschlichen Zyklus nachzubilden.
Doch auch bei Mäusen mit defektem Immunsystem werden die menschlichen Bindegewebs-Zellen und Blutgefäße innerhalb von zwei Wochen durch Mäuse-Zellen ersetzt (5). Auch bei Verwendung von Tieren mit schwerer Immundefizienz kann das menschliche Gewebe nur für einen kurzen Zeitraum erhalten bleiben, so dass keine längerfristigen Versuche möglich sind und die chronische Natur der Endometriose unberücksichtigt bleibt.
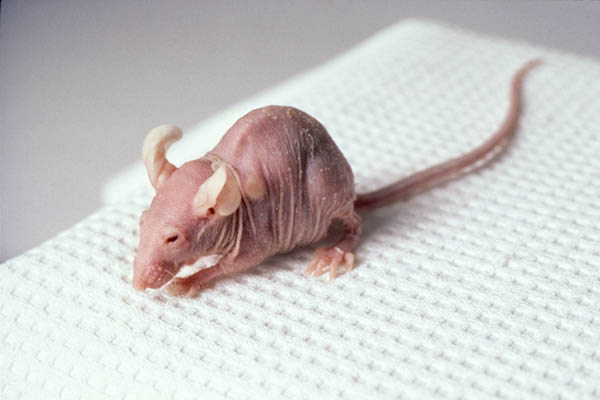
Sogenannte Nacktmäuse haben ein durch Genmanipulation verursachtes, geschwächtes Immunsystem.
Homologe Modelle
Um die Erforschung der Endometriose in immunkompetenten Mäusen, die also über ein funktionierendes Immunsystem verfügen, zu ermöglichen, wird die Gebärmutterschleimhaut aus der gleichen Tierart oder aus demselben Tier verwendet und an verschiedenen Positionen in der Maus implantiert. Dazu wird den Tieren die Gebärmutter entfernt und kleine Stückchen davon beim selben Tier wieder implantiert, vor allem in der Bauchhöhle oder unter der Haut. Solche Modelle wurden für Mäuse, Ratten sowie Hamster und Kaninchen etabliert (7). Bei Ratten bilden sich aus den implantierten Zellen flüssigkeitsgefüllte Zysten, was nicht der Situation beim Menschen entspricht. Und auch beim Kaninchen hervorgerufene Läsionen unterscheiden sich stark von denen beim Menschen (1). Zudem wurde für Mäuse gezeigt, dass die so nachgeahmte Endometriose im Gegensatz zum Menschen keinen Einfluss auf die Fruchtbarkeit hat.
Es gibt wesentliche Unterschiede zwischen der Fortpflanzungsphysiologie von Nagetieren und dem Menschen, so dass Nagetier-„Modelle“ ganz erhebliche Einschränkungen aufweisen. Da Nagetiere nicht menstruieren, entwickeln sie keine spontane Endometriose, und die Krankheit wird künstlich durch die Transplantation von Gebärmuttergewebe ausgelöst, das jedoch nicht dem Endometriosegewebe entspricht. Darüber hinaus enthalten die transplantierten Gebärmutterfragmente in den meisten dieser Nagetierstudien neben der Gebärmutterschleimhaut auch Anteile der darunterliegenden Muskeln, was die Entwicklung der Läsionen beeinflussen kann. Somit bilden die bei Nagetieren induzierten Läsionen die des Menschen nur ungenügend nach. Zudem ist die Endometriose des Menschen eine chronische Erkrankung, die über lange Zeiträume besteht und dabei auch zu einer Vernarbung des Gewebes führt. Diese Veränderungen können dazu führen, dass Wirkstoffe die Endometrioseherde gar nicht erreichen können – ein Umstand, der in Tierversuchen, bei denen lediglich künstlich erzeugte und oberflächliche Endometrioseherde untersucht werden – nicht abgebildet wird (6).
Hühnerembryonen in der Endometrioseforschung
Auch Hühnerembryonen werden in der Endometrioseforschung eingesetzt. Dazu werden die Eischalen geöffnet und die darunterliegende embryonale Membran freigelegt. Auf dieser Membran werden Fragmente von menschlichem Endometriumgewebe kultiviert (4). Weil sich die auf der Membran wachsenden Endometrioseherde einfach beobachten lassen, wird das Modell vor allem für die Untersuchung der Ausbreitung von Endometriose und der dabei auftretenden Neubildung von Blutgefäßen eingesetzt. Für die Untersuchung immunologischer oder entzündlicher Komponenten der Erkrankung oder für die Untersuchung von Wirkstoffen über einen längeren Zeitraum ist das Modell ungeeignet.
Auch wenn sich Hühnerembryonen wesentlich von den menschlichen Patientinnen unterscheiden, wird das Modell verwendet, unter anderem wegen dem mangelnden gesetzlichen Schutz von Vogelembryonen. So bedarf es für Versuche an Hühnerembryonen in Deutschland keiner Genehmigung, da die Richtlinie 2010/63/EU zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere nur für Embryonen von Säugetieren gilt, nicht jedoch für Vogelembryonen (9). So werden die Versuche an Hühnerembryonen von den Experimentatoren sogar als „Alternative“ zum Tierversuch dargestellt.
Auf dem Weg zum perfekten Modell?
Die mangelnde Vorhersagekraft der Tierversuche führt dazu, dass die Forschenden ihre Modelle immer wieder überarbeiten und „verfeinern“. Dies gestaltet sich schwierig, da es sich bei Endometriose um eine komplexe multifaktorielle und heterogene Erkrankung handelt, deren Ursachen nach wie vor noch nicht aufgeklärt sind. Auch ist die Überwachung sogenannter klinischer Endpunkte wie Schmerz oder Unfruchtbarkeit bei Verwendung von Tiermodellen schwierig und langwierig. Die Forschenden erkennen die Rolle der Genomik und Proteomik in der Erforschung der Endometriose an, statt sich dabei jedoch auf die Untersuchung des Menschen zu konzentrieren, erwarten sie, dass transgene Mäuse, in deren Erbgut menschliche Gene eingefügt wurden, eine bessere Untersuchung der Erkrankung ermöglichen werden (7).
Warum Tierexperimente versagen
Die tierexperimentell ausgerichtete Endometrioseforschung hat bis heute kein Heilmittel hervorgebracht und auch neue Behandlungsstrategien - jenseits des Eingreifens in den Hormonhaushalt - fehlen bis heute. Die Fehlerrate für die Entwicklung von Medikamenten im Bereich der Frauengesundheit beträgt über 95 %. Das heißt, dass über 95 % der Wirkstoffe, die im Tierversuch als wirksam und sicher getestet wurden, in den klinischen Phasen - und somit bei ihrer ersten Anwendung beim Menschen - wegen mangelnder Wirksamkeit oder Sicherheit scheitern (10). Ursächlich dafür ist vor allem die fehlende Translation, also die mangelnde Übertragbarkeit von im Tierversuch gewonnenen Erkenntnissen auf den Menschen. Dies beruht zum einen auf dem Unterschied zwischen Mensch und Tier und zum anderen auf der vereinfachten und fehlerhaften Nachbildung von Endometrioseherden in den sogenannten Tiermodellen.
Zudem ist es kaum möglich, die relevanten klinischen Endpunkte wie Schmerzen und verringerte Fruchtbarkeit im Tierversuch nachzuvollziehen. Während Forscher, die mit Nagetieren und anderen „Tiermodellen“ der Endometriose arbeiten, die Verringerung der Läsionsgröße und des Zellwachstums, oder bestimmte Protein- und Genexpressionsdaten als alternative Endpunkte in ihren Untersuchungen einsetzen, ergaben sich daraus bestenfalls spärliche Hinweise für mögliche Weiterentwicklungen der Therapie der menschlichen Endometriose (11).
Die Analyse der verfügbaren Publikationen zeigt, dass Tierversuche somit kaum belastbare Daten liefern, um Wirkstoffkandidaten für klinische Studien bereitzustellen. Daher zweifeln mittlerweile sogar die Forschenden selbst daran, ob diese Tierversuche eine geeignete Strategie für die Untersuchung der Pathophysiologie der Endometriose und für die Entwicklung neuer Therapien darstellen (11).
Somit sind dringend neue Ansätze notwendig, die die menschliche Erkrankung besser widerspiegeln und eine bessere Vorhersagekraft haben (5).
Forschung direkt am Menschen?
Wichtige Erkenntnisse über Endometriose beruhen schon heute auf Untersuchungen am Menschen. So wurden beispielsweise Proben von Endometriose-Patientinnen und Patientinnen ohne Endometriose genommen und die Genexpression der Gewebe miteinander verglichen. Dadurch konnten Gene identifiziert werden, die mit der Erkrankung in Verbindung stehen und so wichtige Erkenntnisse über die molekularen Grundlagen der Erkrankung gewonnen werden (12).
Auch klinische Studien, Beobachtungs- und Assoziationsstudien generieren relevante Ergebnisse.
Um den an den klinischen Studien beteiligten Personen eine möglichst hohe Sicherheit zu bieten – und sich dabei nicht auf eine so unzuverlässige Methode wie den Tierversuch zu verlassen – sollte die Entwicklung und Testung neuer Wirkstoffe an Systemen erfolgen, die vom Menschen abgeleitet sind und somit direkt human-relevante Ergebnisse liefern.
Tierversuchsfreie Forschungsmethoden
Die Untersuchung von Endometriose und entsprechenden Wirkstoffen kann direkt mit menschlichen Zellen erfolgen, was in verschiedenen Kultivierungssystemen möglich ist.
Zellkulturen
Die Analyse von Zellen aus Endometrioseherden und von daraus gewonnenen Zelllinien ermöglicht Einblicke in die Erkrankung und die Untersuchung des Beitrags verschiedener Zelltypen. Insbesondere der Vergleich von Endometriose-Zellen mit denen gesunder Patientinnen gibt Einblick in die Biologie der Erkrankung. Ein Problem ist dabei jedoch, dass primäre Endometriose-Zellen in Zellkultur rasch dedifferenzieren, sich also verändern und die Krankheit dann nicht mehr repräsentieren. Dies kann beispielsweise durch Einbettung der Zellen in eine Fibrin-Matrix verhindert werden (13). Die Verwendung der genetischen Schere CRISPR-Cas ermöglicht es, gezielt Veränderungen im Erbgut der Zellen zu erzeugen und schafft so eine Möglichkeit, die Rolle bestimmter Gene oder Mutationen bei Endometriose gezielt zu untersuchen (12).
Organoide
Organoide sind kleine 3D-Strukturen, die sich in vitro aus gesundem oder erkranktem Gewebe entwickeln lassen und dabei biologische und pathologische Merkmale des ursprünglichen Organs bzw. der Erkrankung beibehalten. Endometriose-Organoide stellen somit vielversprechende Modelle zur Untersuchung der molekularen Mechanismen bei Endometriose dar. Werden Endometrium-Organoide aus Proben von gesunden Frauen und Frauen mit Endometriose miteinander verglichen, zeigt sich ein unterschiedliches Expressionsmuster von Genen, welches Hinweise auf die molekularen Grundlagen der Erkrankung gibt (14). Werden die Organoide mit Progesteron behandelt, zeigt sich eine Fehlregulierung der Genexpression bei Endometriose-Organoiden, die auch erklärt, warum sich bei den entsprechenden Frauen befruchtete Eizellen nicht in die Gebärmutterschleimhaut einnisten können (14).
Endometrium-Zellen zur Züchtung von Organoiden können sogar aus dem Menstruationsblut gewonnen werden (15). Dies stellt eine nicht-invasive Möglichkeit zur Gewinnung Patienten-spezifischer Organoide dar. Zudem lassen sich die Organoide über längere Zeit kultivieren, vermehren und lagern und stehen dadurch nahezu unbegrenzt zur Verfügung. Organoide lassen sich auch in Hydrogele einbetten. Bei Verwendung geeigneter Hydrogele bilden sich dabei durch Gefäßzellen miteinander verbundene Organoid-Netzwerke (13).
Organ-on-a-Chip
Organ-auf-dem-Chip-Systeme basieren auf einem sogenannten mikrofluidischen Chip, auf dem kleine Kultivierungskammern durch feine Kanäle miteinander verbunden sind. In jeder der Kammern können verschiedene Zellen oder Gewebe kultiviert werden und durch die Kanäle zirkulierende Nährflüssigkeit ahmt den Blutstrom nach und transportiert Nährstoffe und Hormone, aber auch zu testende Wirkstoffe zu den Zellen. Die Mikrofluidik-Technologie bietet eine kontrollierte Umgebung, in welcher bspw. Endometriose-Organoide unter standardisierbaren Bedingungen kultiviert werden können. Darüber hinaus ermöglicht diese Technologie eine präzise Steuerung der Zell-Zell- und Zell-Matrix-Interaktionen sowie die Reproduktion der biochemischen und mechanischen Signale und Stimuli. Die Verwendung von mikrofluidischen Systemen ermöglicht auch die Integration von Immunzellen und weiteren Organen wie Leber oder Darm (13), so dass auch systemische Aspekte der Endometriose erfasst werden können.
Die Co-Kultivierung von Endometriose-Organoiden mit aus Läsionen stammenden Stromazellen sowie Immunzellen und Zellen des Binde- und Muskelgewebes in synthetischen extrazellulären Matrizes auf mikrofluidischen Plattformen kann die Nachbildung von mit Blutgefäßen durchzogenen Läsionen und ihrer Umgebung ermöglichen.

Weiblicher Genitaltrakt on-a-Chip. Foto: Northwestern University
3D gedruckte Modelle
Endometrioseherde wachsen in einer komplexen Umgebung, die aus verschiedenen Zellen und der sogenannten extrazellulären Matrix aufgebaut ist. Diese Umgebung kann mittels 3D-Druck nachgeformt werden. Der 3D-Biodruck verwendet dabei biokompatible „Tinten“, beispielsweise aus Hydrogelen, in die Zellen eingeschlossen werden. So lassen sich verschiedene Zelltypen wie Endometriose-, Muskel- und Immunzellen ebenso wie Gefäße, die den Endometrioseherd mit Nährstoffen versorgen, in einer definierten dreidimensionalen Anordnung drucken.
Die verschiedenen tierversuchsfreien Techniken können auch miteinander kombiniert werden, indem beispielsweise Organoide mittels 3D Druck in größeren Konstrukten gedruckt werden oder in mikrofluidischen Systemen eingesetzt werden. Dadurch lassen sich die In-vitro-Systeme beliebig zusammensetzen und erweitern, wodurch sich verschiedenste Organe und Funktionen nachahmen lassen. So ist es möglich, den Eisprung, den Menstruationszyklus und die Einnistung eines Embryos in die Gebärmutterschleimhaut in vitro abzubilden und zu untersuchen (16). Solche komplexen Systeme, die nur aus menschlichen Zellen bestehen, werden in der Endometrioseforschung neue Erkenntnisse liefern und eine für den Menschen relevante Testung neuer Wirkstoffe ermöglichen.
Den Ursachen auf den Grund gehen
Die Ursachen für Endometriose sind nach wie vor nicht geklärt. Die für die Entwicklung von Therapien dringend notwendige Aufklärung der Ursachen und zugrundeliegenden Mechanismen kann sicherlich nicht mit Tierversuchen erfolgen, bei denen lediglich einzelne Aspekte der Erkrankung nachgeahmt werden. Hier sind Bevölkerungs- und Patientenstudien verbunden mit Genom- und Proteomuntersuchungen sowie human-basierte Zell- und Gewebemodelle besser in der Lage, die Ursachen und Mechanismen der Endometriose zu untersuchen.
Vorbeugung
Unter der Annahme, dass die Häufigkeit der Menstruation einen Einfluss auf die Entstehung der Endometriose hat, könnte eine Schwangerschaft einen schützenden Faktor darstellen. Die durchschnittliche Anzahl von Schwangerschaften hat sich in Westeuropa in den letzten 100 Jahren von ca. 10 auf 1,5 verringert, was zu einer Verdopplung der Menstruationshäufigkeit im Leben einer Frau führt und das Risiko, an Endometriose zu erkranken, erhöhen könnte (17). Um dieses Ausbleiben der Menstruation künstlich herbeizuführen, ist auch eine Langzeiteinnahme von oralen Kontrazeptiva möglich. Dadurch wird auch versucht, das Wiederauftreten der Endometriose nach einer Operation zu reduzieren. Während eine solche hormonelle Behandlung also für Endometriose-Patientinnen unter bestimmten Umständen sinnvoll sein kann, scheint es aber fraglich, ob sie zur Prävention der Erkrankung beitragen kann (17). Angesichts der Belastungen und Nebenwirkungen durch eine langfristige Einnahme von Hormonpräparaten kann diese Behandlung nicht als Präventionsmaßnahme empfohlen werden.
Studien zeigen, dass die Ernährung Einfluss auf das Risiko nehmen kann, dass sich Endometriose manifestiert oder verstärkt. Insbesondere wird ein Zusammenhang zwischen einer entzündungsfördernden Ernährungsweise und der Ausprägung von Endometriose diskutiert (18). Risikofaktoren sind unter anderem der Konsum von Alkohol sowie von Transfetten, die vor allem in Milchprodukten, Fleisch und stark verarbeiteten Lebensmitteln enthalten sind. Auch rotes Fleisch steht mit einem erhöhten Risiko in Verbindung. Umgekehrt scheint ein hoher Konsum von Obst – insbesondere von Zitrusfrüchten – das Risiko für eine Manifestation von Endometriose um bis zu 22 % zu senken (19). Darüber hinaus lassen sich die Symptome von Frauen mit Endometriose durch eine Anpassung der Ernährung – insbesondere durch reichlich Gemüse und Obst sowie den Verzicht auf zuckerhaltige Getränke und tierische Fette – vermindern (20).
Fazit
Die überwiegend tierexperimentell ausgerichtete Endometrioseforschung hat bis heute kein Heilmittel für die Erkrankung gefunden und die bestehenden Therapiemöglichkeiten sind unbefriedigend. Dies liegt vor allem an der mangelnden Vorhersagekraft der sogenannten Tiermodelle, bei denen Endometriose-ähnliche Zustände künstlich hervorgerufen werden, die jedoch die komplexe menschliche Erkrankung nicht widerspiegeln. Dies wiegt umso schwerer, als dass noch nicht einmal die Ursachen der Endometriose aufgeklärt wurden, wodurch die Entwicklung einer ursächlichen Behandlung ebenso wie eine zielgerichtete Prävention bis heute nicht möglich sind. Hier kann ausschließlich eine Untersuchung der Erkrankung am Menschen selbst sowie die konsequente Verwendung von human-relevanten und tierversuchsfreien Modellsystemen Abhilfe schaffen.
22.11.2023
Dr. Johanna Walter
Quellen
- Story L. et al. Animal Studies in Endometriosis: A Review. ILAR Journal 2004; 45(2):132–138
- Sasson I.E. et al. Stem Cells and the Pathogenesis of Endometriosis. Annals of the New York Academy of Sciences 2008; 1127(1):106–115
- Rahmioglu N. et al. The genetic basis of endometriosis and comorbidity with other pain and inflammatory conditions. Nature Genetics 2023; 55(3):423–436
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen: Behandlungsmöglichkeiten bei Endometriose (abgerufen am 08.11.2023)
- Groothuis P. Model Systems in Endometriosis Research: Translation, Translation, Translation! Frontiers in Reproductive Health 2022; 3:809366
- Guo S.-W. et al. Is it time for a paradigm shift in drug research and development in endometriosis/adenomyosis? Human Reproduction Update 2018; 24(5):577–598
- Grümmer R. Animal models in endometriosis research. Human Reproduction Update 2006; 12(5):641–649
- D’hooghe T.M. et al. The prevalence of spontaneous endometriosis in the baboon (Papio anubis, Papio cynocephalus) increases with the duration of captivity. Acta Obstetricia et Gynecologica Scandinavica 1996; 75(2):98–101
- Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere
- Kola I. et al. Can the pharmaceutical industry reduce attrition rates? Nature Reviews Drug Discovery 2004; 3(8):711–716
- Malvezzi H. et al. Endometriosis: current challenges in modeling a multifactorial disease of unknown etiology. Journal of Translational Medicine 2020; 18(1):311
- Esfandiari F. et al. HOX cluster and their cofactors showed an altered expression pattern in eutopic and ectopic endometriosis tissues. Reproductive Biology and Endocrinology 2021; 19(1):132
- Gnecco J.S. et al. Physiomimetic Models of Adenomyosis. Seminars in Reproductive Medicine 2020; 38(02/03):179–196
- Esfandiari F. et al. Disturbed progesterone signalling in an advanced preclinical model of endometriosis. Reproductive BioMedicine Online 2021; 43(1):139–147
- Cindrova-Davies T. et al. Menstrual flow as a non-invasive source of endometrial organoids. Communications Biology 2021; 4(1):651
- Mancini V. et al. Organs-On-Chip Models of the Female Reproductive System. Bioengineering 2019; 6(4):103
- Schweppe K.-W. Möglichkeiten zur Prävention der Endometriose – medikamentös und operativ. gynäkologische praxis 2019; 45(3)
- Liu P. et al. Association between dietary inflammatory index and risk of endometriosis: A population-based analysis. Frontiers in Nutrition 2023; 10:1077915
- Harris H.R. et al. Fruit and vegetable consumption and risk of endometriosis. Human Reproduction 2018; 33(4):715–727
- Ott J. et al. Endometriosis and nutrition – recommending a mediterranean diet decreases endometriosis-associated pain: an experimental observational study. Journal of Aging Research & Clinical Practice 2012; 1(2):162–166
