Medizinischer Fortschritt ist wichtig - Tierversuche sind der falsche Weg!
Vielen Dank, dass Sie uns helfen! Denn nur gemeinsam können wir die Tierversuche beenden und eine zukunftsrelevante, leidfreie Forschung zum Wohle von Mensch und Tier durchsetzen. Übrigens: Auch als Mitglied/Fördermitglied unterstützen Sie unsere starke Gemeinschaft.

Ihre persönliche Ansprechpartnerin für alle Fragen zu Spenden und Mitgliedschaft:
Astrid Beckmann
Tel: 02204 99902-0
beckmann@aerzte-gegen-tierversuche.de
Vereinskonto
GLS Gemeinschaftsbank eG
IBAN: DE48 4306 096 7 4126 7406 00
BIC: GENODEM1GLS
Transparenz ist uns wichtig, deshalb haben wir uns der Initiative Transparente Zivilgesellschaft angeschlossen.
11.10.2018
Verschlissene Hüft-, Knie- oder Schultergelenke werden beim Menschen häufig durch künstliche Gelenke ersetzt. Die Testung dieser sogenannten Endoprothesen erfolgte bislang in Tierversuchen. Um Faktoren wie z.B. die mechanische Abnutzung oder Materialermüdung solcher künstlicher Gelenke oder den Einfluss von Körperflüssigkeiten auf das Material zu untersuchen, werden die Prothesen gesunden Tieren, vor allem Schafen, implantiert und bis zu einem Jahr lang auf diese Weise getestet. Da sich Mensch und Tier hinsichtlich Ihrer Statik und des gesamten Bewegungsapparates drastisch unterscheiden, sind solche „Tiermodelle“ ungeeignet und die experimentellen Befunde nicht auf den Menschen übertragbar.
Ein Forscherteam bestehend aus Wissenschaftlern der TU Dortmund und der National University of Science and Technology in Moskau hat nun ein Verfahren entwickelt, das einen zuverlässigen In-vitro-Belastungstest für neuentwickelte Gelenkprothesen bzw. Biomaterialien ermöglicht. Weitere Vorteile gegenüber Tierversuchen sind eine deutlich kürzere Versuchsdauer und die Möglichkeit der exakten experimentellen Standardisierung.
Aufgrund der ständigen Weiterentwicklung von Biomaterialien wie Metall, Keramik oder Polymere für Endoprothesen ist ein zuverlässiges Modellsystem essentiell, um unter streng definierten Versuchsbedingungen aussagekräftige Ergebnisse zu erhalten.
Bei der neu entwickelten LIT-Verfahren (engl. Load Increased Tests) kommt ein hochentwickeltes servo-hydraulisches System zum Einsatz, mit dem das künstliche Gelenk definiert belastet wird, sowie eine synthetisch hergestellte, auf Körpertemperatur erwärmte Flüssigkeit, die das menschliche Blutplasma simulieren soll - ohne den Einsatz von fetalem Kälberserum (FKS), das an dieser Stelle häufig verwendet wurde. Auf diese Weise wird der Einfluss der physiologischen Umgebung einer Endoprothese auf die Materialabnutzung mitberücksichtigt. Als Testmaterial wurde das Polymer UHMWPE (engl. Ultra-high molecular weight polyethylene) eingesetzt, das sich bei Gelenkprothesen bereits medizinisch bewährt hat.
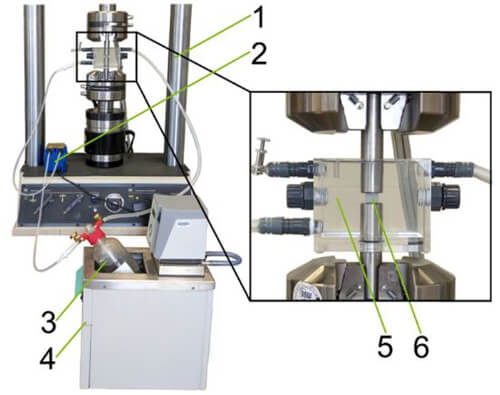
Versuchsaufbau des In-vitro-LIT-Systems zur Untersuchung der Abnutzung von Biomaterialien unter Verwendung von SBF. 1: Servo-hydraulisches Testsystem, 2: Peristaltische Pumpe, 3: SBF (simulierte Körperflüssigkeit), 4: Thermostat, 5: Korrosionszelle, 6: Biomaterial-Probe.
Der Belastungstest des Biomaterials dauert bis zu 8 Tage und umfasst über 110.000 Testzyklen, wobei die Kompressionskraft exakt definiert und stetig erhöht werden kann. Der Zustand des Materials wird hinsichtlich diverser Parameter nach 1, 2, 5 und 8 Tagen mit verschiedenen Analyseverfahren untersucht.
Die Forscher konnten in Ihrer Studie zeigen, dass die Kombination des servo-hydraulischen Systems und der Flüssigkeit, die das humane Blutplasma simuliert, wichtig ist, um zuverlässige Messergebnisse zur Materialabnutzung zu erhalten. Im Gegensatz zu Tierversuchen stellt diese In-vitro-Methode ein innovatives Testsystem dar, mit dem die Abnutzung von Gelenkprothesen im menschlichen Körper präzise untersucht werden kann.
Originalartikel:
Scholz R et al.: Development of biomimetic in vitro fatigue assessment for UHMWPE implant materials. J Mech Behav Biomed Mater. 2018; 85: 94–101
Das Cochlea-Implantat ist ein kleines Gerät, das bei Menschen mit schwerer Schallempfindungsschwerhörigkeit eingesetzt wird und ihnen wieder ermöglicht zu hören. Es besteht aus einem Mikrofon, das den Schall aufnimmt, einem Sprachprozessor, der die Schallwellen in elektrische Impulse umwandelt, die dann über die Sendespule an die Elektroden in der Hörschnecke (Chochlea) übertragen werden. Diese Elektroden stimulieren dann den Hörnerv, der die Impulse ans Gehirn weiterleitet. Mikrofon, Sendespule und Sprachprozessor werden außerhalb am Körper getragen. Das Cochlea Implantat (CI) umgeht also die beeinträchtigten Innenohrstrukturen und leitet die Schallinformationen als elektrische Impulse direkt an den Hörnerv. (1)
Pioniere
1800: Alessandro Volta (1745-1827), ein italienischer Physiker und Erfinder der Batterie, wagte ein Selbstexperiment, in dem er Batterien mit zwei Metallstäben verband. Diese führte er sich in sein Ohr ein, dabei bemerkte er ein Rütteln in seinem Kopf und nahm ein Geräusch wahr. In den darauffolgenden Jahren führten unterschiedliche Wissenschaftler an sich selbst Versuche mit verschiedenen Stromstärken durch. (1)
1855 verwendete Duchenne de Boulogne erstmals Wechselstrom für diese Art des Versuchs. Im späteren Verlauf wurden noch andere Stromquellen eingesetzt. (2)
Erste Versuche
1957 entwickelten der Elektrophysiologe André Djourno (1904-1996) und der Otologe Charles Eyriés in Paris das erste funktionierende Cochlea Implantat. Am 25. Februar 1957 wurde es einem gehörlosen Patienten implantiert, woraufhin dieser in der Lage war, Geräusche und einfache Worte zu erkennen. Außerdem wurde seine Fähigkeit des Lippenlesens verbessert. Die Arbeit von Djourno und Eyriés wurde nur in Frankreich veröffentlicht. (2, 3)
1963 starteten Fritz Zöllner, Otologe aus Freiburg, und Wolf-Dieter Keidel, Sinnesphysiologe aus Nürnberg, ein eigenes Projekt, das vorsah, die Elektroden in der Cochlea zu platzieren. Zöllner und Keidel erbrachten wichtige Erkenntnisse, die später verwirklicht werden konnten. (1)
1964 implantierte Blair Simmons von der Stanford University ein Implantat mit 6 Elektroden. Er zeigte mit diesem Versuch erfolgreich, dass mit verschiedenen Stimulationen verschiedene Empfindungen einhergehen. (2)
Das Cochlea Implantat wird einsatzreif
1960er Jahre: William F. House erfuhr von der Arbeit der beiden Wissenschaftler Djourno und Eyriés. In Zusammenarbeit mit den Brüdern John Doyle, Neurochirurg, und James Doyle, Elektroingenieur, entwickelte House ein Cochlea-Implantat aus Golddraht, das er den beiden ersten Patienten einsetzte. Die Resultate waren vielversprechend, wurden aber durch lokale Infektionen beeinträchtigt. (3, 4)
House arbeitete mit dem Elektroingenieur Jack Urban zusammen. Urban entwickelte ein Operationsmikroskop und löste die bei der Entwicklung der Implantate auftretenden mechanischen und elektronischen Probleme. Anfangs wussten weder Urban noch House, welche Art Strom sie verwenden sollten, um den Patienten das Hören zu ermöglichen, „so we just had to experiment“. Der erste freiwillige Patient war Charles Graser, ein Hochschullehrer, der schwere Verbrennungen erlitten hatte und durch die Einnahme des Antibiotikums Streptomycin vollständig ertaubt war. 1972 war Graser der erste Patient, der mit einem Langzeitmplantat das Testlabor verließ. (4) Das von House entwickelte Implantat hatte nur eine Elektrode, um die Informationen zum Hörnerv zu leiten und war dadurch kostengünstiger, aber genauso gut und auch für die Armen in aller Welt erschwinglich. (5)
1978: Graeme Clark von der Universität Melbourne implantiert weltweit das erste mehrkanalige intracochleäre System mit transkutaner (über die Haut) Übertragung und tragbarem Sprachprozessor. (2)
Die Rolle der Tierversuche
In den frühen 1970er Jahren gab es sehr kontroverse Diskussionen um das Cochlea Implantat. Man bezweifelte den Sinn und Erfolg dieser Methode und forderte angesichts einer solch rigorosen Methode die Überprüfung in „Tiermodellen“. (3) Deshalb führte House einige seiner Studien zum Cochlea Implantat an Patienten und Tieren durch. (6)
Eine Gruppe Wissenschaftler an der Universität von San Francisco unter Leitung von Michael Merzenich und Robert Schindler überprüften in der zweiten Hälfte der 1970er Jahre die Sicherheit und Anwendbarkeit von Langzeitimplantaten im sogenannten „Katzenmodell“. (3) Üblicherweise wird dabei gesunden jungen, teilweise neugeborenen Katzen eine hörschädigende Substanz wie Neomycin ins Innenohr oder unter die Haut gespritzt. Nach der Ertaubungsphase werden den Katzen Elektroden implantiert, um die Hörfähigkeit zu testen. (7, 8)
Alle Tierversuche wurden erst nach der eigentlichen Erfindung des Cochlea-Implantats durchgeführt und dienten nur der Bestätigung der Ergebnisse der klinischen Forschung. Sie waren zu keinem Zeitpunkt an der Entwicklung beteiligt. Entscheidend für die Entwicklung waren erfindungsreiche, experimentierfreudige und mutige Wissenschaftler, vertrauensvolle Patienten und Ingenieure, die entsprechende Geräte wie das Operationsmikroskop, die Batterie und verträgliche Materialien entwickelten. Angesichts der Tatsache, dass es um ein Gerät geht, das von menschlicher Sprache verursachte Schallwellen in elektrische Impulse umwandelt und über den Hörnerven zum Hörzentrum leitet, fragt man sich doch, wie man auf die Idee kommen kann, dieses Gerät an Tieren zu testen, die einerseits ein vielfach empfindlicheres Hörorgan haben, andererseits nicht sprechen können. Die Entwicklung des Cochlea-Implantats ist ein weiteres Beispiel für die Absurdität des Tierversuchs.
3.9.2018
Katharina Feuerlein, Ärztin

Quellen
(1) Kapek, Claudia: Die Geschichte des Cochlea-Implantats, Ein technisches Wunderwerk erobert die Welt. Historisches 29.03.2017
(2) Carl von Ossietzky Universität Oldenburg, Informatik und Gesellschaft – Gruppe EE; Elektronische Ersatzteile für den Körper: Das Cochlea Implantat
(3) Niparko, John K.; Nager, George T.: Cochlear Implants: Principles & Practices. 2nd Edition 2000, Philadelphia; London: Lippincott Williams & Wilkins
(4) Smaka, Carolyn: Audiology online: Interview with William House, 29. August 2011
(5) Martin, Douglas: Dr. William F. House, Inventor of Pioneering Ear-Implant Device, Dies at 89, The New York Times 15. Dezember 2012 (abgerufen am 3.9.2018)
(6) Jung, Ute; Die geschichtliche Entwicklung des Cochlear-Implants (PDF, abgerufen am 3.9.2018)
(7) Kral, A. et al.: Postnatal cortical development in congenital auditory deprivation. Cerebral Cortex 2005; 15(5): 552-562
(8) Dinse, H. et al.: Optical imaging of cat auditory cortex cochleotopic selectivity evoked by acute electrical stimulation of a multi-channel cochlear implant. European Journal of Neuroscience 1997; 9: 113-119
In den 1920er Jahren bemerkten Farmer in Kanada und den USA, dass in ihren Viehherden Tiere durch innere Blutungen qualvoll verendeten. Wie sich herausstellte, hatten sie Klee gefressen, der von Schimmelpilz befallen war. Diese Schimmelpilze produzierten eine gerinnungshemmende Substanz, die isoliert werden konnte und den Namen „Dicumarol“ erhielt.
Im Jahr 1948 kam eine synthetische Form namens „Warfarin“ als Rattengift auf den Markt. Die damit vergifteten Ratten sollten wie die Rinder verbluten.
1951 versuchte ein Mitglied der US Navy, sich mit Warfarin das Leben zu nehmen – doch er erholte sich vollständig. So entdeckte man, dass Warfarin für den Menschen nicht toxisch war und sogar lebensrettende Eigenschaften besaß. Man konnte damit der Entstehung von Blutgerinnseln vorbeugen und Krankheiten wie Infarkte, Thrombosen und Embolien behandeln.
1955 erhielt der amerikanische Präsident Dwight D. Eisenhower nach einem Herzinfarkt Warfarin. Danach hieß es: „Was für einen Kriegshelden und den Präsidenten der Vereinigten Staaten gut ist, muss für jedermann gut sein, auch wenn es Rattengift ist!“
3.9.2019
Katharina Feuerlein, Ärztin

Quelle
Dobson M: Die Geschichte der Medizin, National Geographic History 2013; Band 373: S.183
„Juli 1846. Nächste Woche trete ich meine Stelle als ‚Herr Doktor' auf der ersten Station der Entbindungsklinik im Allgemeinen Krankenhaus von Wien an. Ich war entsetzt, als ich vom Prozentsatz der Patienten hörte, die in dieser Klinik sterben. In diesem Monat starben dort sage und schreibe 36 von 208 Müttern, alle an Kindbettfieber. Ein Kind zur Welt zu bringen ist genauso gefährlich wie eine Lungenentzündung ersten Grades.“ (1)
Diese Zeilen aus dem Tagebuch von Ignaz Semmelweis (1818-1865) illustrieren die verheerenden Auswirkungen des Kindbettfiebers, einer ansteckenden Krankheit, an der im vorletzten Jahrhundert viele Frauen nach der Geburt eines Kindes starben. Die Ärzte, darunter auch Semmelweis, tappten in Bezug auf die Ursache des Kindbettfiebers völlig im Dunkeln. Semmelweis schrieb in sein Tagebuch: „Dezember 1846. Warum sterben so viele Frauen nach einer völlig problemlosen Geburt an diesem Fieber? Seit Jahrhunderten lehrt uns die Wissenschaft, es handle sich um eine unsichtbare Epidemie, die Mütter tötet. Als mögliche Ursachen gelten Veränderungen in der Luft, irgendwelche außerirdischen Einflüsse oder eine Bewegung der Erde selbst, ein Erdbeben.“ (1)
Heutzutage würde kaum jemand außerirdische Einflüsse oder ein Erdbeben als mögliche Ursachen für Fieber in Erwägung ziehen. Zu Lebzeiten von Semmelweis taten dies allerdings viele, auch Wissenschaftler. Semmelweis ließ es aber nicht dabei bewenden, sondern sammelte Daten über die Todesfälle auf Grund von Kindbettfieber und stellte fest, dass Ärzte und Medizinstudenten, die vor der Untersuchung der Wöchnerinnen Leichen seziert hatten, offensichtlich eine Art „Leichengift“ übertrugen. Er führte die Händedesinfektion ein und reduzierte damit die Zahl der Erkrankungen drastisch. Obwohl noch niemand etwas von krankmachenden Bakterien ahnte, hatte Semmelweis das Problem durch sorgsame Beobachtung erkannt und Abhilfe geschaffen. Doch statt Anerkennung erntete er die Feindschaft seiner Fachkollegen, die nicht wahrhaben wollten, dass sie selbst jene Krankheit verursachten, die sie heilen wollen. Die Opposition der Wissenschaftswelt war derart hartnäckig und feindselig, dass Ferdinand Hebra, einer der wenigen Befürworter der Semmelweis'schen Theorie, schrieb: „Wenn man dereinst die Geschichte menschlicher Fehler erzählt, wird man nur schwerlich ein so machtvolles Beispiel finden, und man wird verblüfft sein, wie derart fähige und spezialisierte Menschen in ihrer eigenen Wissenschaft so blind und so dumm sein konnten.“ (2)
Semmelweis erlebte die Bestätigung seiner Erkenntnisse nicht mehr. Er starb 1865, zwei Jahre bevor der schottische Arzt Joseph Lister (1827-1912) Desinfektion und Hygiene in die Chirurgie einführte und damit die Todesrate im Operationssaal massiv senkte. Semmelweis und Lister gelangten zu ihren Erkenntnissen durch Beobachten und Vergleichen.
3.9.2018
Dr. med. vet. Corina Gericke

Quellen
(1) OECD Programme for International Student Assessment: Pisa 2000, Beispielaufgaben aus dem Naturwissenschaftstest
(2) Di Trocchio, F: Newtons Koffer - Geniale Außenseiter, die die Wissenschaft blamierten, Campus-Verlag, Frankfurt, 1998
Schon ca. 1780 v. Chr. wurden in Ägypten Wunden durch das Aufbringen von schimmeligem Brot und anderen verschimmelten Lebensmitteln (Mais, Obst) behandelt.
1640 erklärte der Londoner Apotheker und königliche Kräuterarzt John Parkington, Schimmel habe eine heilende Wirkung bei Infektionen.
Am 3.9.1928 kehrte der Schotte Alexander Fleming aus dem Urlaub in sein Labor zurück. Er war 47 Jahre alt und Professor für Bakteriologie am St. Mary‘s Hospital in London. Ungewaschene Petrischalen waren auf seinem Labortisch stehen geblieben, in denen er Staphylococcus aureus (Erreger verursacht z.B. Geschwüre, Abszesse, Pneumonien) kultiviert hatte. Eine Petrischale fiel ihm auf: in dieser Schale waren um einen grünlichen Schimmelflecken herum keine Staphylokokken gewachsen! 1929 gab er dem Schimmelpilz den Namen „Penicillin“ und schickte Proben davon an Laboratorien in USA und Europa.
Erst 10 Jahre später, im Jahr 1939 bestätigte ein Forscherteam aus Oxford (Howard Florey, Ernst Chain und Norman Heatley), die schon bekannte Wirkung im Tierversuch. Sie verabreichten weißen Mäusen eine hohe Dosis virulenter Streptokokken. Die Hälfte der Mäuse wurde anschließend Penicillin gespritzt. Am nächsten Morgen waren die unbehandelten Mäuse tot, die behandelten überlebten.
1941 litt der 43-jährige Oxforder Polizist Albert Alexander an einer schweren Sepsis infolge einer infizierten Kratzwunde. Anfänglich half das verabreichte Penicillin, der Zustand besserte sich. Leider war man nicht in der Lage, trotz erfindungsreicher Methoden (Schimmelpilze in Bettpfannen und Milchkannen, Rückgewinnung des mit dem Urin ausgeschiedenen Penicillins) genügend Penicillin zu beschaffen. So konnte man die Therapie nicht fortsetzen, Alexander starb 4 Wochen später.
Das Produktionsproblem wurde von Norman Heatley gelöst. Er entdeckte in Illinois in einem Agrarlabor eine Methode, den Schimmelpilz mittels Fermentation heranzuziehen. Schon bald stellten etliche pharmazeutische Unternehmen Penicillin her.
1943 brachten Feldversuche bei den Verwundeten der Schlachtfelder Nordafrikas spektakuläre Erfolge. Soldaten, die ansonsten Gliedmaßen verloren hätten oder an Wundbrand gestorben wären, überlebten dank Penicillin.
1945 erhielten Fleming, Florey und Chain den Nobelpreis für Medizin „für die Entdeckung des Penicillins und seiner heilenden Wirkung bei verschiedenen Infektionskrankheiten“. Der eigentliche Entdecker war jedoch Fleming.
Nach der heutigen Art der Wirkstofftestung, die eine Palette von Tierversuchen vorschreibt, wäre Penicillin nie auf den Markt gekommen, da es tödlich für Meerschweinchen, Kaninchen, Hamster und Chinchillas ist. Das Mittel tötet die lebensnotwendigen Darmbakterien, die Tiere sterben an Dauer-Durchfall.
3.9.2019
Katharina Feuerlein, Ärztin

Quelle
Dobson M: Die Geschichte der Medizin, National Geographic History 2013; Band 373: S. 186 ff
Frühjahr 1929. Der junge Assistenzarzt Werner Forßmann arbeitete unter Sanitätsrat Richard Schneider in der chirurgischen Abteilung des Auguste-Viktoria-Heims in Eberswalde.
Schon während des Studiums war ihm die Ungenauigkeit und Unsicherheit der Herzdiagnostik aufgefallen. Perkussion, Auskultation, Röntgenuntersuchung und EKG (Elektrokardiogramm) waren die Standardmethoden, wovon Perkussion und Auskultation so weitgehend von den Sinnesorganen der jeweiligen Untersucher abhingen, dass sie einer subjektiven Deutung viel zu großen Spielraum ließen. Immer wieder erlebte Forßmann, „dass unsere klinischen Diagnosen in einem nicht vertretbaren Maße von dem abwichen, was der Pathologe auf dem Obduktionstisch demonstrierte.“ Das war besonders für diejenigen schmerzlich, denen eine rationelle Herzchirurgie vorschwebte. (1)
Denn wenn, wie sein Zeitgenosse Geheimrat Ferdinand Sauerbruch es einmal ausgedrückt hat, die Chirurgie die Heilmethode ist, die mechanisch angreifbare Krankheitszustände mit mechanischen Mitteln beseitigt, lag es auf der Hand, dass dieser Schritt gegangen werden musste! (1)
Forßmann: „Ich glaubte, dass das Problem gelöst werden könnte, wenn man einen Weg fände, auf dem man gefahrlos in das Herz eindringen konnte, ohne die komplizierten Druckverhältnisse im Thorax zu stören, ohne vegetative Reflexbahnen anzutasten und ohne wichtige Lebensfunktionen durch eine Narkose zu verändern.“ (1)
Seit über 70 Jahren war diesen Fragestellungen schon in Tierexperimenten nachgegangen worden. Forßmann hatte während seines Studiums alte Abbildungen der Arbeiten von Claude Bernard, Chaveau und Marey gesehen, ihm erschien aber der bei den Tierversuchen verwendete Zugang über die große Halsvene oder auch die oberflächlichen Halsvenen als ungeeignet. Er wählte wegen des gradlinigen Verlaufs, der geringeren Komplikationen und der Anordnung der Klappen den Zugang über die Venen in der Ellenbeuge. (1)
Im Frühsommer 1929 trug Forßmann Sanitätsrat Schneider seinen Plan vor und erbat dessen Zustimmung zur Ausführung des Experiments. Schneider lehnte ab, nicht weil er den Plan für schlecht hielt, im Gegenteil! Er hielt den Plan für gut und richtig, traute sich aber nicht, Experimente an seinem kleinen Hause durchzuführen, die nicht an großen Kliniken erprobt waren. Der von Forßmann vorgeschlagene Selbstversuch wurde ihm ebenfalls verboten. Forßmann war aber so besessen von seinem Plan, dass er beschloss, diesen Selbstversuch heimlich durchzuführen.
Schwester Gerda Ditzen, die sich bereit erklärt hatte, den Versuch bei sich durchführen zu lassen, wurde im letzten Moment von Forßmann „übertölpelt“ und musste zusehen, wie er sich den Katheter selbst legte, für sie waren nur kleine Hilfsleistungen vorgesehen.
Forßmann schob einen Ureteren-Katheter durch seine eigene freigelegte Ellenbogenvene, erreichte unter Röntgenkontrolle bei 30 cm seinen Oberarmkopf, schob den Katheter bis zur 60 cm-Marke weiter und „jetzt zeigte der Spiegel den Katheter im Herzen und mit seiner Spitze im rechten Ventrikel, genau wie ich es mir vorgestellt hatte.“ (1)
Sanitätsrat Schneider warf Forßmann anschließend Wortbruch und Vertrauensmissbrauch vor, wurde aber durch die Röntgenfilme überzeugt und gratulierte Forßmann mit den Worten: „Sie haben etwas ganz Großes entdeckt!“ Am 5. November 1929 erschien Forßmanns Arbeit „Über die Sondierung des rechten Herzens“ in der „Klinischen Wochenschrift“.
1956 erhielt Werner Forßmann den Nobelpreis für Medizin. In einem Radio-Interview aus diesem Jahr berichtete er, dass er selbst auf vorausgehende Tierversuche verzichtet hat, um die Ungefährlichkeit dieser Methode am Menschen zu beweisen! (2) Die später von ihm durchgeführten Tierversuche zeigten, dass Tiere (Kaninchen und Hunde) die Kontrastmittelgabe „gar nicht so gut“ vertragen wie der Mensch. Forßmann hätte den Selbstversuch nicht gewagt, wenn er die Tierversuche vorangestellt hätte.
Jahre später erfuhr Werner Forßmann von Prof. Dr. Hans Schadewaldt von einer Veröffentlichung von H. Stürzbecher mit dem Titel „Die Cholera, Dieffenbach und Catheterisierung des Herzens 1831“ (Deutsch. Med. Journal 1971; 22: 470-471). Demnach hatte jemand vor ihm bereits einen Herzkatheter gelegt. Johann Friedrich Dieffenbach hatte einen Katheter über eine Arterie in das linke Herz eingeführt, um bei einem sterbenden Cholerakranken durch mechanische Reize die Herztätigkeit anzufachen. (1)
3.9.2019
Katharina Feuerlein, Ärztin

Quellen
(1) Forßmann, Werner: Selbstversuch - Erinnerungen eines Chirurgen. Verlag Dr. Köster Berlin, 4. Auflage 2009; S. 99 -115
(2) SWR2: Selbstversuche in der Naturwissenschaft und Medizin, 8.8.2017
Die Geschichte des Herzschrittmachers zeigt beispielhaft, wie Fortschritt in der Medizin zustande kommt. Am Anfang steht die Not eines Arztes, der Wunsch nach besseren diagnostischen oder therapeutischen Möglichkeiten, vielleicht auch nur einfache Neugier. Dann fehlen noch die entsprechende Technik und das Genie der Ingenieure, die diese Technik beherrschen.
Im Fall des Herzschrittmachers kam noch ein weiteres Problem hinzu: das Herz galt Jahrhunderte lang als Sitz der Seele, und der Stillstand des Herzens bedeutete das Ende des Lebens. Wer versuchte, hier einzugreifen, machte sich des Frevels schuldig.
Die Pioniere
Diese Denkweise bekommt auch der australische Anästhesist Mark C. Lidwell zu spüren. 1926 erweckt er ein totgeborenes Kind durch elektrische Stimulation des Herzens zum Leben. Aufgrund von massiven Anschuldigungen führt er keine weiteren Experimente an Menschen durch.
1930 konstruiert der New Yorker Kardiologe Alfred Hyman einen 7,2 kg schweren Apparat zur künstlichen Elektrostimulation des Herzens. Kommt es zu einem Herzstillstand, wird eine Nadel durch die Brust in den rechten Vorhof gestochen. Mit Hilfe eines geringen elektrischen Stroms wird das Herz wieder in Gang gebracht. Die Frequenz der elektrischen Impulse pro Minute können dabei gesteuert werden. Nichts anderes macht der natürliche Taktgeber im Herzen, der Sinusknoten. Er sendet winzige elektrische Impulse an den Herzmuskel und bewirkt so das Schlagen des Herzens. Bis März 1932 setzt Hyman seinen Schrittmacher 43 Mal bei Patienten ein, in 14 Fällen mit Erfolg. Die Reaktion der Fachwelt und der Presse ist verheerend. Hyman wird vor Gericht gezerrt, man beschuldigt ihn der „frevelhaften Einmischung in die göttliche Vorsehung“. Daraufhin verzichtet Hyman auf eine Publikation seiner Reanimationsversuche bei Menschen und veröffentlicht nur die Ergebnisse von Tierversuchen. Er fälscht sogar – vermutlich absichtlich - eine Literaturangabe, um den Kollegen Lidwell zu schützen. Seine Arbeit ist Hyman bekannt, er zitiert den Kollegen jedoch unter dem Namen „Gould“. Dieser erfundene Kollege hat nachweislich nie existiert, ist aber noch heute in der Darstellung der Frühgeschichte des Herzschrittmachers zu finden.
Unblutige Methoden
1949 graben die beiden kanadischen Herzchirurgen John Callaghan und Wilfred Bigelow Hymans Methode wieder aus. Sie entwickeln zusammen mit dem Elektroingenieur John A. Hopps eine Elektrode, mit deren Hilfe ein Herzstillstand von einem externen Schrittmacher reanimiert werden kann.
Paul M. Zoll vom Beth Israel Hospital in Boston kommt 1952 auf seiner Suche nach einem unblutigen Weg zur Erkenntnis, dass eine Elektrostimulation des Herzens auch durch den Brustkorb hindurch mit 2 Plattenelektroden möglich ist. 1952 kann Zoll zum ersten Mal bei einem 75jährigen Mann mit einer schweren Herzrhythmusstörung für 25 Minuten eine wirksame Stimulation des Herzens durchführen. Versuche mit 2 weiteren Patienten sind erfolgreicher. Zoll veröffentlicht seine Ergebnisse im „New England Journal of Medicine“. Auch er bekommt den Zorn der Kollegen zu spüren, die ihm „Handeln wider Gottes Willen“ vorwerfen.
Zolls Methode hat Nachteile: sie ist schmerzhaft und zeitlich nur begrenzt anwendbar. Seymour Furman, Chirurg am Montefiore Hospital in New York, bastelt 1958 aus einem handelsüblichen Herzkatheter, einem Stahldraht und etwas Stanniol seine erste, über eine Vene einführbare Elektrode.
Implantierbarer Herzschrittmacher 1958
Im Karolinska Hospital in Stockholm liegt der 43 Jahre alte Arne Larsson, der infolge einer akuten Myokarditis an einer schweren Herzrhythmusstörung (totaler AV- Block) leidet und nur durch wiederholte Faustschläge auf die Brust und Injektionen ins Herz reanimiert werden kann. Åke Senning, Chirurg am Karolinska Hospital, und Ingenieur und Erfinder Dr. Rune Elmquist arbeiten schon länger an der Entwicklung eines implantierbaren Schrittmachersystems. Die von ihnen durchgeführten Tierversuche konnten besonders die technischen Probleme nicht lösen. Gedrängt von der verzweifelten Ehefrau des Patienten baut Elmquist den ersten implantierbaren Schrittmacher, der nur 3 Stunden hält. Das 2. Aggregat hält etwas länger. 1961 erhält Arne Larsson einen Schrittmacher mit Quecksilberbatterien. Beim 7. Internationalen Schrittmacherkongress 1983 ist Larsson, der inzwischen den 23. Schrittmacher trägt, lebendiger Zeuge für 25 Jahre erfolgreiche Schrittmacherbehandlung. Er stirbt 2001 mit 86 Jahren.
In den Jahren nach diesem ersten Einsatz werden immer kleinere und leistungsstärkere implantierbare Schrittmacher entwickelt, die heute zahlreiche Leben retten.
3.9.2019
Katharina Feuerlein, Ärztin

Quellen
Mannebach, Hermann: Hundert Jahre Herzgeschichte - Entwicklung der Kardiologie 1887-1897. Springer Verlag 1988; S. 74-84
Beating heart is revived by electrified needle. In: Popular Mechanics Magazine, 1933, S. 360
GEO Chronik: 100 Triumphe der Medizin, Verlag Gruner + Jahr GmbH & Co KG, Hamburg 2017, S. 95
Die Geschichte der Anästhesie
(griechisch an- „ohne“ und aisthesis, „Gefühl, Empfindung“, also die Ausschaltung der Schmerzempfindung)
Es muss eine Tortur gewesen sein, sich ohne jede Betäubung operieren oder Zähne ziehen zu lassen, sowohl für Patienten als auch für Ärzte. Jahrhunderte lang versuchte man, Patienten mit allen erdenklichen Mitteln unempfindlich gegen Schmerzen zu machen. (1)
Erste Ansätze
Älteste Überlieferungen aus Mesopotamien aus dem Jahr 3000 v.Chr. berichten über die Verwendung von Bilsenkraut, Hanf, Mohn, Wein, Bier und Alraune. (3)
Im 12. Jahrhundert wurden Schlafschwämme beschrieben, die mit Opium und anderen Pflanzenextrakten getränkt waren. (3) Auch physikalische Methoden wie Kompression von zuführenden Blutgefäßen oder Nervenstämmen durch Knebel, Aderlässe und Kälte kamen zur Anwendung. (2)
Die Geschwindigkeit von Operationen war lange Zeit das ausschlaggebende Kriterium für chirurgische Qualität. Blutungen, Schmerzen und Infektionen hatten eine Sterblichkeit von 90% zur Folge, so dass Operationen nur im äußersten Notfall durchgeführt wurden. (2)
Die Anästhesie war eine der bedeutendsten und zugleich auch umstrittensten Entdeckungen des 19. Jahrhunderts, Chirurgen hatten lange nach einer solchen Methode gesucht, doch wurden die ersten Anästhetika – Äther (Diethylether) und Lachgas (Distickstoffmonoxid) - zufällig entdeckt. Lachgas war bereits seit Ende des 18. Jahrhunderts bekannt. Es wurde als Droge auf Jahrmärkten, unter Studenten und sogar von Gästen gediegener Abendgesellschaften als Partydroge benutzt. (4, 5)
Die Pioniere
Crawford W. Long führte 1841 im Städtchen Jefferson, Georgia, eine Arztpraxis und einen Arzneimittelladen. Abends saß er oft mit Nachbarn zusammen und atmete berauschende Dämpfe ein. Er bemerkte, dass ihm Verletzungen im Ätherrausch keine Schmerzen verursachten. 1842 operierte Long den 21-jährigen James M. Venable im Dampf des Schwefeläthers an einem Tumor im Nacken: die erste schmerzfreie Operation der Welt! Da er seine Ergebnisse aber nicht veröffentlichte, erfuhr kaum jemand vom Sieg des Menschen über den Schmerz. (5)
Im Jahr 1844 fiel dem Zahnarzt Horace Wells (1815-1848) im US-Bundesstaat Connecticut während einer Jahrmarktsvorführung auf, dass ein junger Mann unter Einfluss von Lachgas die Schmerzen in seinem verletzten Bein anscheinend gar nicht spürte. Daraufhin setzte Wells Lachgas erfolgreich bei seinen Patienten ein. Als er seine Methode jedoch am Massachusetts General Hospital in Boston vorführen wollte, schrie der vermeintlich eingeschlafene Patient auf und Wells wurde als Scharlatan aus dem Saal gejagt. Sein Narkosemittel war auf Jahre diskreditiert, Wells gab seinen Beruf auf und beging wenige Jahre später Selbstmord. (4,6)
Wells‘ ehemaliger Partner, der Zahnarzt William Morton (1819-1868), saß am 30. September 1846 entmutigt in seiner Praxis. Er suchte Testpersonen. Er hatte Goldfische und Vögel mit Ätherdunst betäubt, er hatte die Wirkung im Selbstversuch, an einem Hund und an seinen Assistenten getestet. Er wollte beweisen, dass dieser Stoff für die Medizin geeignet ist, von dem die Fachbücher berichteten, er habe in Tierversuchen zu Schlaganfällen und zum Tode geführt. An diesem 30. September nun bat ein Mann mit vereitertem Backenzahn Morton um Hilfe. Der Patient fürchtete die Schmerzen der Behandlung. Morton operierte und verfasste anschließen einen Fachartikel. (1, 5) Seither gilt Morton als Entdecker der Äthernarkose, weil er als Erster darüber publizierte. Der eigentliche Entdecker war jedoch Long, der ohne Tierversuche in reiner Selbstbeobachtung den Grundstein für die Anästhesie legte.
Die Neuigkeit der schmerzfreien Operation war in der Welt. Nun brauchte Morton Patienten. Er wandte sich an den Chirurgen John Collins Warren, der ihn sofort nach Boston einlud, um seine Erfindung zu demonstrieren. Am 16.Oktober 1846 war der Operationssaal der Bostoner Klinik überfüllt. Der Patient, ein 20-jähriger Drucker mit einer großen Blutgefäßgeschwulst zwischen Unterkiefer und Kehlkopf, atmete einige Minuten lang durch den Inhalator, der mit einem äthergetränkten Meeresschwamm gefüllt war. Der Patient schlief ein, Warren begann zu operieren. Der gefürchtete Initialschrei beim Durchstechen der Haut blieb aus. Warren wandte sich fassungslos zum Publikum und sprach die Worte: „Gentlemen, dies ist kein Humbug“. (1, 5)
Die Vorteile der Anästhesie waren unbestreitbar, jedoch tat man sich mit der richtigen Dosierung schwer. Bei zu niedriger Dosierung wurden die Patienten unruhig und benahmen sich oft „unschicklich“, so dass die Chirurgie eher als Farce erschien. Die Schwierigkeiten entstanden dadurch, dass die wissenschaftlichen Hintergründe der Anästhesie nicht bekannt waren und die Narkose einfach ausprobiert wurde. Erst durch die Untersuchungen des Londoner Mediziners John Snow (1813-1858) konnten die physikalischen und chemischen Eigenschaften des Äthers und seine Wirkung auf das Nervensystem geklärt werden.
Der narkotisierende Effekt von Chloroform wurde von dem britischen Chirurgen Robert Mortimer Glover (1815-1859) 1842 und dem französischen Physiologen Marie-Jean-Pierre Flourens 1847 in Tierversuchen an Hunden beschrieben. Beide erkannten jedoch nicht die Bedeutung des Chloroforms für die Humanmedizin (7), was eindrücklich zeigt, dass bei tierversuchsorientierten Forschern der Tierversuch oft zum Selbstzweck wird. Es war der schottische Gynäkologe Sir James Young Simpson (1811-1870), der am 4.11.1847 in Edinburgh mit 2 Kollegen im Selbstversuch die narkotische Wirkung des Chloroforms erkannte und anschließend in die Humanmedizin einführte. Bereits Tage später entband er unter Chloroformbetäubung erfolgreich die Frau eines Kollegen, das neugeborene Mädchen erhielt den Namen „Anästhesia“. Im selben Jahr prägte der amerikanische Anatom Oliver Wendell Holmes (1809-1894) den Begriff der „Anästhesie“. (4, 6) Chloroform erlangte später einen hohen Bekanntheitsgrad, nachdem John Snow Königin Viktoria (1819-1901) bei der Geburt ihres 8. Kindes Chloroform verabreichte. (1, 4, 6)
Sowohl Äther als auch Chloroform wurden bis ins 20. Jahrhundert in der Chirurgie verwendet, bis neue Narkosemittel wie z.B. die intravenös verabreichten Barbiturate entwickelt wurden und Erfindungen wie das Laryngoskop oder der endotracheale Tubus die Intubationsnarkose ermöglichten. Diese Entwicklungen erhöhten die Sicherheit und senkten das Sterberisiko auf 1:100 000. (4, 6)
Fazit
Jahrtausende langes Experimentieren, scharfes Beobachten und mutiges Handeln hat die Grundlagen für die Anästhesie geschaffen. Technischen Erfindungen und neue Wirkstoffe ebneten dann den Weg für moderne Narkoseverfahren.
Die Rolle der Tierversuche
Der Zahnarzt William Morton hat Äther an Goldfischen, Vögeln und einem Hund ausprobiert, aber auch an seinen Assistenten und sich selbst und schließlich an Patienten. Er hat damit bewiesen, dass Äther für Menschen sehr wohl geeignet ist, obwohl die Fachliteratur behauptete, dass Äther in Tierversuchen zu Schlaganfällen und zum Tod geführt habe und deshalb für Menschen gefährlich sei. Dies ist ein weiteres Beispiel dafür, dass man Ergebnisse aus Tierversuchen nicht übertragen kann und wie sehr es die biomedizinische Forschung voranbringen kann, wenn man diese Ergebnisse hinterfragt.
3.9.2018
Katharina Feuerlein, Ärztin

Quellen
(1) Dobson M: Die Geschichte der Medizin. National Geographic History 2013; Band: S. 92-95 und S. 113
(2) Zak, Eva: Narkose einst und jetzt. Semesterarbeit im Rahmen der Weiterbildung für Führungsaufgaben im mittleren Managementbereich, 2003-2004 (PDF, abgerufen am 3.9.2018)
(3) Kliman, Jonathan: Geschichte der Narkose. Christian Doppler Laboratory, Medizinische Universität Wien, 2013
(4) Bynum, William und Helen: Die großen Entdeckungen in der Medizin. Dumont Verlag 2012; S. 218-221
(5) Geo Chronik: Die großen Momente der Menschheit Nr.1 - 100 Triumphe der Medizin. Verlag Gruner + Jahr GmbH & Co KG, Hamburg, 2017; S. 58-61
(6) Volk, Thomas: Die Geschichte der Anästhesie. (ohne Jahresangabe)
(7) Wikipedia: Robert Mortimer Glover (abgerufen am 3.9.2018)
William Withering (1741-1799), der am Birmingham General Hospital praktizierte, erhielt von einer alten Dame eine Rezeptur für die Behandlung von Wassersucht (Flüssigkeitseinlagerungen im Gewebe als Folge z.B. von Herzschwäche). Der Arzt und Botaniker fand heraus, dass die wichtigste Zutat der Arznei der Rote Fingerhut war, der zwar hochgiftig ist, doch bei gewissenhafter Anwendung und in geringer Dosierung die Herztätigkeit anregen kann, den Urinfluss verstärkt und Ödeme ausschwemmt. Er untersuchte an über 160 Patienten systematisch die diuretische (wasserausschwemmende) Wirkung der Inhaltsstoffe verschiedener Pflanzenteile des Fingerhuts. Diese beispielhaft sorgfältigen und systematischen therapeutischen Studien machten Withering zum Begründer der modernen klinischen Pharmakologie und der evidenzbasierten Medizin. Er unterschied zwischen toxischen (Erbrechen, Durchfall, Sehstörungen) und therapeutischen (Diurese) Dosierungen.
1785 veröffentlichte er Aufzeichnungen über seine Versuche und den medizinischen Nutzen der Pflanze.
Die Wirkstoffe des Roten Fingerhuts (Digitalis purpurea) und des Wolligen Fingerhuts (Digitalis lanata) werden bis heute in der Medizin verwendet um Frequenz und Leistung der Herzaktionen zu verbessern.
Wenn man in früheren Jahren Katzen zur Testung verwendet hätte, wäre diese Substanz sicher nie zum Einsatz gekommen. Bei Katzen kann Digoxin wegen einer Stoffwechselbesonderheit (schlechte Glukuronidierung) giftig wirken.
3.9.2019
Katharina Feuerlein, Ärztin

Quelle
Dobson M: Die Geschichte der Medizin, National Geographic History 2013; Band 373: S. 127







