„Alternativen“ zu Tierversuchen
Was versteht man eigentlich unter „Alternativmethoden“? Der Begriff ist in Anführungszeichen gesetzt, da er impliziert, man müsse Tierversuche nur einfach durch eine andere, „alternative“ Methode ersetzen. Der Tierversuch ist jedoch nicht nur ethisch, sondern insbesondere wissenschaftlich ein veraltetes System. Mit Blick auf den medizinischen Fortschritt ist der Tierversuch sogar ein fatal irreführender Forschungsweg, da er keine zuverlässig auf den Menschen übertragbare Ergebnisse liefert. Anzumerken ist auch, dass eine „Alternativmethode“ nicht zwangsläufig tierversuchsfrei ist, sondern genauso Verfahren umfasst, die lediglich leidmindernd sind oder mit weniger Tieren auskommen. Mehr dazu lesen Sie im Abschnitt über das 3R-Prinzip.
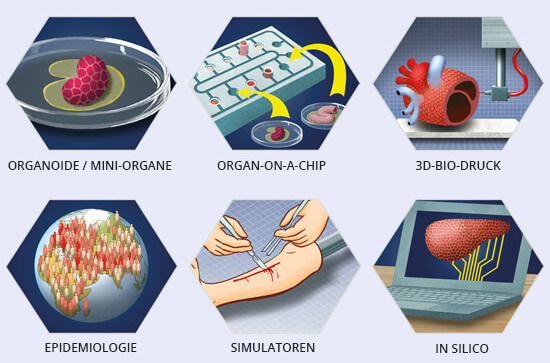
Tierversuchsfreie Methoden, die menschliche Zellen oder Daten nutzen, haben gegenüber dem Tierversuch, den entscheidenden Vorteil, dass sie für den Menschen relevante Ergebnisse liefern. Die Entwicklungen in diesem Bereich gehen rasant voran. So gibt es eine große Bandbreite an tierversuchsfreien Forschungsmethoden, wie Zellkulturforschung, Computermodelle, Miniorgane, komplexe Multi-Organ-Chips oder epidemiologische Forschung. Dies sind keine „Alternativen“, die einen Tierversuch lediglich ersetzen, sondern es sind hochrelevante Systeme, die im Gegensatz zum Tierversuch einen wesentlichen Fortschritt in Medizin und Forschung bringen.
Im Folgenden finden Sie eine Auswahl an innovativen tierversuchsfreien Forschungsmethoden. In unserer Datenbank Non Animal Technologies können Sie zudem nach bestimmten Verfahren und Bereichen filtern.
Vorbemerkungen
Viele der tierversuchsfreien Modelle können zwar nicht vorhersagen, wie ein kompletter Organismus, ein ganzer Mensch, reagieren wird. Allerdings können Tierversuche dies genauso wenig. Bei Tieren handelt es sich zwar um einen ganzen Organismus, aber um den falschen. Dagegen liefern tierversuchsfreie Methoden mit menschlichen Zellen und Geweben, Miniorganen oder Multi-Organ-Chips, kombiniert mit speziellen Computerprogrammen, die auf menschlichen Daten basieren, im Gegensatz zum Tierversuch, genaue und für den Menschen aussagekräftige Ergebnisse.
- In vitro: im Reagenzglas; Test-Systeme mit schmerzfreier Materie wie Zellen oder Gewebe
- In vivo: Versuche, die im lebenden Organismus stattfinden
- In silico: Computersimulationen
Warum tierische Zellen die falsche Wahl sind
Viele der modernen Testmethoden greifen auf tierisches Material wie Zellen, Gewebe, Organe oder auch Schlachtabfälle zurück. Solche Modelle sind ethisch ebenso wenig zu rechtfertigen wie ein Tierversuch. Aus wissenschaftlicher Sicht macht es zudem keinen Sinn, an tierischen Zellen oder Organen zu forschen, da sie vom falschen Organismus stammen und somit gravierende Fehlergebnisse hervorbringen können, wie von Wissenschaftlern zunehmend erkannt wird. Wird beispielsweise eine Sonnencreme an Hautzellen getestet, die von Mäusen stammen, kann man nicht vorhersehen, wie die menschliche Haut oder gar verschiedene Hauttypen reagieren werden. Viel zu groß sind die Unterschiede im Aufbau der einzelnen Hautschichten von Maus und Mensch und in der Empfindlichkeit der menschlichen Hauttypen.
Fetales Kälberserum
Es ist erfreulich, dass immer mehr Forscher mit Zell- oder Gewebekulturen arbeiten, um vom Tierversuch wegzukommen. Die Zellkulturen jedoch brauchen ein Nährmedium, um am Leben erhalten zu werden und wachsen zu können. Dafür ist es heute noch immer gängige Praxis, sogenanntes Fetales Kälberserum (FKS) zu verwenden. Dieses wird aus dem Blut ungeborener Kälber gewonnen, indem ihnen mit einer Nadel direkt ins Herz gestochen wird. Es wird so lange Blut abgesaugt, bis es blutleer ist und das Kalb stirbt. Das ist ethisch nicht zu rechtfertigen und überdies gibt es Nährmedien, die dem FKS wissenschaftlich überlegen sind, beispielsweise aus menschlichem Blut. Mehr dazu lesen Sie hier: Mehr zu FKS-freien Nährmedien >>
3R – Reduce, Refine, Replace
Wenn man sich mit „Alternativmethoden“ befasst, stößt man immer wieder auf den Begriff der 3R. Was versteht man darunter? 3R steht für Reduce, Refine, Replace (Reduzieren, Verfeinern, Ersetzen).
Die britischen Wissenschaftler W. Russel und R. Burch haben 1959 das sogenannte 3R-Konzept ins Leben gerufen.
Der Tierversuch als Methode wird dabei nicht in Frage gestellt. Vielmehr soll mittels Ersatz (Replacement) durch nicht oder weniger leidensfähige Systeme, durch Verminderung (Reduction) der Anzahl der Tiere oder durch Verfeinerung (Refinement), z.B. Verminderung der Schmerzen für die Tiere oder tierfreundlichere Haltungsbedingungen, das bestehende tierexperimentelle System verbessert werden. Eine Abkehr vom Tierversuch wird bei diesem Konzept nicht in Erwägung gezogen. Unsere ausführliche Position zum 3R-Konzept lesen Sie hier >>
Innovative tierversuchsfreie Methoden
Zellforschung

In solchen Well-Platten wachsen Zellkulturen.
Man unterscheidet primäre und permanente Zellkulturen. Primäre Zellen werden direkt aus dem Organismus gewonnen. Menschliche Zellen, z.B. von Leber, Haut, Knorpel oder Knochenmark, stammen aus „Abfallmaterial“ von klinisch notwendigen Operationen, Organspenden sowie Plazenten und Nabelschnüren, die bei Geburten anfallen. Primäre Zellen sterben nach einer gewissen Zeit ab. Ihre Kultivierung ist also nur zeitlich begrenzt möglich.
Zellen, die sich über einen langen Zeitraum kultivieren lassen, bezeichnet man als permanente Zellen. Sie können sich unaufhörlich teilen und sind praktisch unbegrenzt lebensfähig. Dies ist häufig bei Tumoren der Fall. Mittlerweile gibt es viele Tausende von verschiedenen Zelllinien.
Dank modernster Techniken lassen sich heute selbst komplexe Strukturen des menschlichen Körpers im Reagenzglas „nachbauen“. So ist es gelungen, die menschliche Haut mit ihren diversen Schichten verschiedener Zellen sowie dreidimensionale Herz-, Leber- und Knorpelgewebe oder Blutgefäße nachzubilden.
An Herzmuskelzellen beispielsweise lassen sich im Reagenzglas physiologische Vorgänge und die Wirkung von Herzmedikamenten untersuchen. Die menschliche Augenhornhaut lässt sich mit all ihren Schichten nachbauen. Es ist möglich daran beispielsweise Augentropfen zu testen.
Ein System aus menschlichen Leberzellen eignet sich zum Testen neuer Medikamentenwirkstoffe. In einer Vergleichsstudie wurde ein Antikrebswirkstoff parallel in einer klinischen Studie am Menschen, an Ratten und am menschlichen Leberzellsystem getestet. Die Ergebnisse der Versuche am Menschen und an den Leberzellen stimmten überein. Der Tierversuch brachte ein irreführendes Resultat. (1)
2010 gelang es Wissenschaftlern erstmals, sogenannte Organoide zu züchten. Das sind dreidimensionale Zellkulturen, die die Funktionen eines menschlichen Organs realitätsnah widerspiegeln. Diese werden aus menschlichen Haut- oder Haarwurzelzellen hergestellt. Mit Hilfe von gentechnischen Verfahren werden die Zellen in induzierte pluripotente Stammzellen umprogrammiert und können sich in jeden Zelltyp entwickeln.
Allein mit der Forschung an Zellen und Geweben lassen sich also humanbasierte Erkenntnisse gewinnen. Von Kritikern wird diese oft als zu einfach abgetan, da sie nicht einen ganzen Organismus abbilden kann. Abgesehen davon, dass das mit dem Tierversuch genauso wenig möglich ist, kann die tierversuchsfreie Forschung weit mehr, wie die nachfolgenden Abschnitte eindrucksvoll zeigen.
Organchip-Technologie

Mini-Organe oder Organiode sind nur wenige Millimeter große Abbilder echter Organe. Meist werden sie aus induzierten pluripotenten Stammzellen (iPS) gebildet und auf kleinen Kunststoff-Chips aufgebracht. Die Miniaturisierung ermöglicht eine Automatisierung von Testabläufen, so dass sich tausende Substanzen in kürzester Zeit testen lassen, zuverlässig, preisgünstig und schnell und – im Gegensatz zum Tierversuch – auf den Menschen übertragbar. Diese Organchip-Systeme sind nicht nur aus ethischen Gründen auf dem Vormarsch, weil so unzähligen Tieren der Tod im Labor erspart bleibt, sondern auch, weil sie viel effektiver sind. Zudem legen sie den Grundstein für die personalisierte Medizin. Bei diesem Zukunftsmodell wird aus Zellen eines Patienten ein Patient-auf-einem-Chip generiert, an dem nun speziell auf ihn zugeschnittene Medikamente getestet werden können.
Inzwischen gibt es eine Vielzahl solch fantastischer Organ-Chips. Hier nur eine kleine Auswahl. Mehr zu Mini-Organen und Multi-Organ-Chips >>
Nerven-auf-dem-Chip
Ein Wissenschaftler-Team am Leibniz-Institut für Analytische Wissenschaften, dem Leibniz-Institut für Arbeitsforschung und der Universität Dortmund hat ein Nervennetz auf einem Biochip entwickelt, das gegenüber Tierversuchen und selbst herkömmlichen Zellkulturen entscheidende Vorteile hat. Gesunde Nervenzellen (Neuronen) im Gehirn versuchen auch in einer Kulturschale Fortsätze zu bilden und miteinander in Kontakt zu treten. Im Gehirn sind die Vernetzungsvorgänge von Nervenzellen, die das ganze Leben lang anhalten, die Voraussetzung von Erinnerungsvermögen und Lernen. Stoffe, die bei Neuronen die Vernetzung behindern, bewirken unter anderem Gedächtnisstörungen. In herkömmlichen Zellkulturen müssen Anzahl und Länge der gebildeten Fortsätze einzeln unter dem Mikroskop ausgezählt werden, um die Nerven schädigenden Eigenschaften von aufgeträufelten Chemikalien zu untersuchen. Auf dem Biochip wachsen die Neuronen in sechseckigen Silikongittern. Durch die regelmäßige Anordnung lässt sich die Beurteilung automatisieren – das mühsame Auszählen entfällt. Der Test ist sehr viel genauer und empfindlicher als jeder Tierversuch. (2)
Lunge-auf-dem-Chip
Wissenschaftler des Wyss-Instituts an der Harvard Universität haben eine Art künstliche Lunge auf einem Labor-Chip entwickelt. In einem System aus winzigen Mikrokanälchen aus flexiblem Kunststoff werden menschliche Lungenzellen angesiedelt. Die Kanälchen lassen sich durch ein Vakuum strecken. So kann die natürliche Atmungsbewegung der Lungenbläschen nachgeahmt werden. Eine Testsubstanz wie beispielsweise ein Nanopartikel aus Siliziumoxid wird mit einem Luftstrom in das System geleitet, um den Übergang von Substanzen in der Atemluft in die Lungenbläschen nachzustellen. (3) Zudem entwickelten die Wissenschaftler ein Gerät, das Zigaretten raucht und so die Wirkung von eingeatmetem Rauch auf menschliche Lungenzellen in Form von Luftwegkanälen auf einem Chip untersuchen kann. Dies ist das erste Gerät seiner Art und zeigt die toxischen Wirkungen von normalem und elektronischem Zigarettenrauch auf die menschliche Lunge, vor und nach der Exposition. Die Forscher nutzen den Chip auch um mögliche Therapien für die chronisch obstruktive Lungenerkrankung (COPD), eine der häufigsten Todesursachen in den USA, zu erforschen. (4)
Auch im Bereich der tierversuchsfreien Lungenkrebsforschung gibt es fantastische Innovationen. Forscher entwickelten ein Lungen-Chipmodell, um das Wachstum von menschlichen Lungenkrebszellen zu untersuchen und neue Krebsmedikamente zu entwickeln. Dieses Chip-Modell ermöglicht es den Forschern, das Verhalten von Lungenkrebs in einer menschenrelevanten Mikroumgebung zu untersuchen und Ergebnisse zu liefern, die mit denen in klinischen Studien am Menschen übereinstimmen. (5)
Haut-auf-dem-Chip
Eine vollautomatische Untersuchungsmöglichkeit von Kosmetika haben Wissenschaftler der FH Jena entwickelt. Auf einem mit winzigen Schläuchen durchzogenen fingerkuppengroßen Chip werden menschliche Hautzellen gesät. Mit elektrochemischen Methoden und mit Hilfe einer Kamera wird gemessen, wie die Zellen auf eingeschleuste giftige oder reizende Substanzen reagieren. (6)
Niere-auf-dem-Chip
Forscher an der Universität von Michigan, Ann Arbor, entwickelten eine Niere-auf-dem-Chip, der die Filterfunktion der menschlichen Niere nachahmt. Er ermöglicht Tests in einer kontrollierten, reproduzierbaren Umgebung und hat die Fähigkeit, den Flüssigkeitsstrom zu ändern, um ein breites Spektrum von Nierenfunktionen zu simulieren. Er kann verwendet werden, um die Arzneistoffdosierung zu optimieren, das Verhalten von Medikamenten im Körper über die Zeit zu modellieren und den Filterprozess der Medikamente in den Nieren zu simulieren. (10)
Arterie-auf-dem-Chip
Kanadische Wissenschaftler haben auf einem Mikrochip kleine Arterienabschnitte langzeitkultiviert. Das System eignet sich zur Überprüfung von herz- und kreislaufwirksamen Medikamenten und es kann automatisiert werden, d.h. eine große Anzahl potentieller Wirkstoffe kann in kürzester Zeit durchgetestet werden. Zu kritisieren ist, dass Blutgefäße von Mäusen verwendet wurden, was aus ethischen und wissenschaftlichen Gründen abzulehnen ist. Der Einsatz von menschlichen Blutkapillaren wäre dagegen sinnvoll und sicherlich möglich. (11)
Darm-on-a-Chip
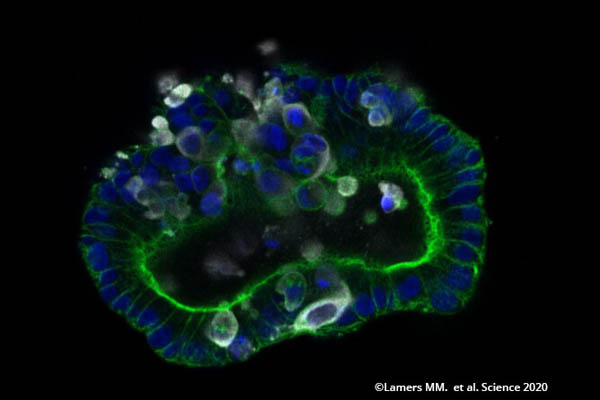
Forscher des Wyss Institute for Biologically Inspired Engineering an der Harvard-Universität in Boston, Massachusetts, USA, haben einen menschlichen Minidarm in der Größe eines USB-Sticks kreiert, der kleine Schläuche enthält, die innen mit menschlichen Dünndarmzellen ausgekleidet werden. Außen fließt eine Flüssigkeit vorbei, die das Blut in den kleinen Blutgefäßen des Darms simuliert. So kann der Übergang von Substanzen aus dem Blut in den Darm studiert werden. Im Darmlumen haben die Wissenschaftler Bakterien der menschlichen Darmflora angesiedelt, die bei der Verstoffwechslung von Substanzen und der Entstehung vieler Krankheiten eine bedeutende Rolle spielen. Mittels einer Vakuumpumpe werden die Schläuche gestreckt und gestaucht, um die Darmperistaltik nachzuahmen. Die Forscher wollen auf diese Weise Krankheiten wie Morbus Crohn besser erforschen und neue Therapien entwickeln. (12)
Eine Forschergruppe an der Technischen Universität München konnte Darmorganoide für die Untersuchung von Nährstoff- und Medikamenten-Aufnahme etablieren. Zudem zeigten die Wissenschaftler, dass die Organoide, wie der echte Darm auch, Hormone ausschütten, wenn sie mit bestimmten Nähstoffen (wie z.B. Zucker) stimuliert werden. Diese Prozesse sind wichtig für die Insulin-Ausschüttung und die Regulation unseres Blutzuckerspiegels. Erkrankungen wie Typ 2-Diabetes oder eine gestörte Aufnahme bestimmter Nährstoffe, z.B. Fruktose-Malabsorption, können mit menschlichen Darmorganoiden erforscht und Medikamente getestet werden. (13)
Leber-auf-dem-Chip
Londoner Wissenschaftler haben ein menschliches Leber-auf-einem-Chip-Modell mit Hepatitis B infiziert und Immunreaktionen gegen das Virus entschlüsselt, die denen in echten menschlichen Lebern ähneln. Dieses erste Modell einer Infektion in einem menschlichen Organ in vitro hat Wege aufgezeigt, mit denen das Hepatitis-B-Virus der menschlichen Immunabwehr in der Leber ausweicht, was einen möglichen neuen Weg für die therapeutische Entwicklung darstellt. Im Gegensatz zu Tieren reproduziert dieses 3D-Modell die Virusinfektion ähnlich wie beim Menschen. (14)
Plazenta-auf-dem-Chip
Die Plazenta ist eines der komplexesten und am wenigsten verstandenen Organe des menschlichen Körpers. Es regelt den Transport essentieller Nährstoffe zwischen Mutter und Fötus und dient gleichzeitig dem Schutz des ungeborenen Kindes vor gefährlichen Substanzen im Blut der Mutter. Frühere Studien an „Tiermodellen“ stimmten nicht mit Ergebnissen überein, die in gespendeten menschlichen Plazentagewebe gefunden wurden. Um ein physiologisch relevanteres Modell zu erstellen, arbeiteten Forscher der Universität von Pennsylvania und der Universität von Colorado zusammen, um eine Plazenta auf einem Chip zu entwickeln, die den Transport von Stoffen zwischen der Mutter und dem ungeborenen Kind simuliert. Diese Forschung verspricht neue Einblicke auch auf dem Gebiet der Frühgeburten, die bis zu einer von zehn Schwangerschaften weltweit betreffen kann. (15)
Zunge-auf-dem-Chip
Die Muskeldystrophie ist eine seltene unheilbare Erbkrankheit, die von frühester Kindheit an zu fortschreitender Muskelschwäche führt, bei der auch unter anderem die Zunge betroffen sein kann. Forscher haben einen Chip entwickelt, um diese Krankheit mit menschlichen Stammzellen von Patienten nachzuahmen. Diese Zunge-auf-einem-Chip kann dazu dienen, neue Einsichten über die Krankheit beim Menschen zu erfahren. Zum Beispiel haben die Forscher den Chip verwendet, um zu entdecken, dass ein reiferer Stammzelltyp, der Muskeln namens Myoblasten hervorbringt, nicht den normalen Signalen folgen kann, um richtige Muskeln zu bilden und stattdessen kleinere, schwächere Muskeln entstehen lässt. Neben der Grundlagen- und Therapieforschung kann dieser Chip auch von Klinikern zur Diagnose und Überwachung des Krankheitsverlaufs bei Patienten eingesetzt werden. (16)
Herz-auf-dem-Chip
Forscher der Harvard-Universität, Boston, entwickelten ein 3D-gedrucktes Gerät, um das menschliche Herz nachzuahmen. Im Gegensatz zu früheren Geräten enthält dieses Herz-auf-dem-Chip eingebettete Sensoren, die das Schlagen von Herzmuskeln erkennen können. Das Gerät kann ferner Herzen von verschiedenen Personen nachahmen. Die Forscher untersuchten im Anschluss Arzneimittelreaktionen an den jeweiligen Herzen. Ihre neuartige Bioengineering-Methode ebnet den Weg zu anderen ähnlichen Geräten, um ohne Tierversuche die Sicherheit neuer Medikamente zu verbessern. (17)
Auge-auf-dem-Chip

An der University of Pennsylvania, Philadelphia, wurde ein Auge-auf-dem-Chip aus menschlichen Augenhornhaut- und Bindehautzellen entwickelt. Um die Situation möglichst realistisch nachzubilden, haben die Forscher ein mechanisches Augenlid gebaut, das sich über der Hornhaut auf und ab bewegt. Die schützende und Feuchtigkeit verteilende Funktion des Lids ist für das Auge essenziell. So können chronische Augenkrankheiten wie trockenes Auge erforscht und neue Wirkstoffe getestet werden. (18)
Gehirn-auf-dem-Chip
Seit einigen Jahren ist es möglich, menschliche Mini-Gehirne aus humanen Stammzellen für die biomedizinische Forschung zu züchten, um daran unter anderem Funktionen des menschlichen Gehirns zu untersuchen.
Selbst Minigehirne mit Nervenzellen aus verschiedenen Hirnregionen sind bereits entwickelt worden. Mit dieser Methode konnte u.a. untersucht werden, wie das Zika-Virus das Gehirn eines ungeborenen Kindes schädigt. Das Virus hat vor allem in Brasilien zu zahlreichen Neugeborenen mit einem ungewöhnlich kleinen Kopf und kleinen Gehirn geführt. Mit Hilfe des Minihirns kamen Forscher dem Mechanismus auf die Spur. Die erbsengroßen Organe lassen sich sogar standardisieren, d.h. Tausende absolut gleiche Minihirne können eingefroren und gelagert werden. Alzheimer, Autismus, Schizophrenie oder Parkinson sollen so erforschbar werden – Krankheiten, bei denen der Tierversuch auf ganzer Linie versagt hat. (19) Mehr zu Mini-Gehirnen >>
Multi-Organ-Chip - der „Mini-Mensch“
An der amerikanischen Cornell University wurde eine Art künstlicher-Organismus-auf einem-Chip entwickelt. In einem System aus winzigen Gängen und Kammern auf einem Mikrochip werden menschliche Zellen von beispielsweise Magen, Darm, Leber, Blut oder Niere angesiedelt. Ein Wirkstoff zirkuliert in einer Nährflüssigkeit durch den künstlichen Mini-Menschen. Die Wirkung in den einzelnen Organen, seine Verstoffwechslung sowie die mögliche Entstehung giftiger Abbauprodukte können so getestet werden. Sogar Krankheiten des Menschen können mit dem Mikrochip nachgeahmt werden. So können Kombinationen von Wirkstoffen in mit Krebszellen beschichteten „Organen“ des Chips auf ihre Wirksamkeit und Sicherheit geprüft werden. Tests, die am Tier Monate dauern, lassen sich mit Hilfe der Chips innerhalb von ein bis zwei Tagen durchführen. (7) Das System ist inzwischen patentiert und wird von der amerikanischen Firma Hurel vertrieben.
Wissenschaftler der Berliner Firma TissUse haben Multi-Organ-Chips entwickelt. Diese werden mit menschlichen Zellen z.B. von Darm, Haut, Leber, Niere bestückt, die in einer dreidimensionalen Umgebung wachsen und die menschlichen Organe nachbilden. Die Organmodelle sind durch kleine Kanäle verbunden, welche mit Hilfe einer Mikropumpe eine naturgetreue Versorgung der Organe ermöglichen. Hierdurch können Auswirkungen von Arzneimitteln, kosmetischen Inhaltsstoffen, Chemikalien und Lebensmittelzusätzen auf den Organismus vorhergesagt werden. (8)
Forscher der Universität Twente im niederländischen Enschede haben ein Lab-on-Chip-Gerät entwickelt, mit dem die Auswirkungen von Arzneimitteln oder toxischen Substanzen auf den Menschen schneller getestet werden können. Der Chip ist in der Lage, Entgiftungsreaktionen nachzuahmen, die im menschlichen Körper auftreten. Der Chip ermöglicht es so, die sehr schnellen Reaktionen beim Menschen im Detail außerhalb des menschlichen Körpers zu untersuchen und die Verwendung von Tierversuchen für solche Zwecke zu ersetzen. (9)

NAT-Database - Die Datenbank zu tierversuchsfreien Forschungsmethoden
Unzählige tierversuchsfreie Verfahren und Technologien wurden insbesondere in den letzten 10 Jahren in den Bereichen Medizin und Biowissenschaften entwickelt und täglich kommen neue hinzu. Mit der weltweit einzigartigen „NAT-Database“ bieten wir einen Überblick und informieren über die ungeheuren Möglichkeiten der tierversuchsfreien Forschung.
www.nat-database.deBevölkerungsstudien

Epidemiologische Untersuchungen sind von unschätzbarem Wert, wenn es um den Erkenntnisgewinn hinsichtlich der Entstehung menschlicher Erkrankungen geht.
Unter Epidemiologie versteht man Bevölkerungsstudien, also Untersuchungen an Gruppen von Menschen. Auf diese Weise können die Zusammenhänge zwischen bestimmten Krankheiten und dem Lebensstil sowie den Lebensumständen von Menschen, wie Ernährung, Gewohnheiten und Arbeit, aufgedeckt werden. Die Epidemiologie entwickelte sich aus der Beobachtung von Infektionskrankheiten. Im 19. Jahrhundert konnten hygienische und soziale Missstände als Ursachen für die Seuchenzüge der damaligen Zeit identifiziert werden. Aufgrund der Ergebnisse aus epidemiologischen Untersuchungen konnten vorbeugende Maßnahmen abgeleitet werden.
Auf diese Weise wurde beispielsweise die Beziehung zwischen Rauchen und Krebs aufgedeckt. Noch in den 1950er Jahren bezweifelte man die schädlichen Auswirkungen des Rauchens, nicht zuletzt aufgrund irreführender Tierversuchs-Ergebnisse. Die Auswertung von 7.000 epidemiologischen Studien im ‚Surgeon General‘s Report on Smoking and Health’ im Jahr 1964 ließ keinen Zweifel mehr offen: Zigarettenrauch verursacht Lungenkrebs und chronische Bronchitis. (20)
Jahrzehntelang wurden die krebserregenden Eigenschaften von Asbest verleugnet, weil Ratten den Stoff wesentlich besser tolerieren als der Mensch. In einer Studie wurde festgestellt, dass Menschen gegenüber Asbest 300-mal empfindlicher sind als Ratten. In einer anderen Untersuchung mussten Ratten eine 100-fach höhere Konzentration Asbest als Asbestarbeiter einatmen, um Lungenkrebs zu bekommen und sogar eine 1000-fach höhere, um Krebs des Bauch- und Brustfells zu entwickeln. Hamster sind gegenüber Asbest sogar noch unempfindlicher (21). Die krebsauslösende Wirkung von Asbest wurde schließlich durch Studien mit Asbestarbeitern aufgedeckt.
Unser Wissen über die Übertragungswege des HIV und über die vor AIDS schützenden Maßnahmen beruht ausschließlich auf epidemiologischen Studien. Im Fall von AIDS ist Vorbeugung nicht nur das bessere Heilmittel, sondern das einzige.
Die wohl berühmteste und zugleich längste epidemiologische Studie ist die Framingham-Studie, in deren Rahmen seit 1948 die Bewohner der gleichnamigen Stadt in Massachusetts, USA, bezüglich ihrer Herz-Kreislauf-Gesundheit beobachtet werden. Von den ursprünglich 5.209 Bürgern sind inzwischen die meisten verstorben, doch die Studie wird mit ihren Kindern und Kindeskindern fortgeführt. Die in nunmehr über Jahrzehnte gewonnenen Daten brachten bahnbrechende Erkenntnisse bezüglich der Risikofaktoren, der Entstehung, des Fortschreitens und der Folgen von Herz-Kreislauf-Erkrankungen. Schon in den 1960er Jahren wurde klar: Rauchen, hoher Cholesterin-Spiegel, hoher Blutdruck, Fettleibigkeit, Bewegungsmangel sowie psychosoziale Faktoren erhöhen das Risiko für Herz-Kreislauf-Erkrankungen.
Microdosing
Microdosing ist eine Technik im Bereich der Arzneimittelforschung, bei der Freiwillige eine extrem kleine Dosis eines potentiellen Medikamentes verabreicht bekommen. Aufnahme, Verteilung, Verstoffwechselung und Ausscheidung des Stoffes werden mit hochempfindlichen Methoden gemessen. Eine Microdosis ist so klein, dass sie keinerlei pharmakologische Wirkung bei der Versuchsperson hat. In regelmäßigen Blut- und Urinproben wird der Weg der Substanz durch den Körper verfolgt.
3D-Bio-Druck
Computersimulationen / in silico

Technisch ausgefeilte Computermodelle können Informationen über Struktur, Wirkung und Giftigkeit von Substanzen, wie zum Beispiel von neuen Arzneimitteln oder Chemikalien, liefern. Computermodelle wie QSAR (Quantitative Structure Activity Relationship) basieren auf menschlichen Daten. Unter Einbeziehung der Molekularstruktur einer Substanz kann ihre wahrscheinliche Wirkung vorausgesagt werden. Andere Modelle, wie CADD (Computer-Assisted Drug Development) werden von der Pharmaindustrie eingesetzt, um potentiell unwirksame oder toxische Stoffe schon auf einer frühen Stufe der Arzneimittelentwicklung auszusondern.
Für die Testung einer neuen Chemikalie wird üblicherweise eine Palette von Versuchen an verschiedenen Tierarten durchgeführt. Ein Team um den Toxikologen Dr. Dr. med. Thomas Hartung von der Johns Hopkins Bloomberg School of Public Health in Baltimore hat ein intelligentes Computersystem entwickelt, mit dessen Hilfe sich die Giftigkeit von neuen Chemikalien anhand von Daten einer riesigen Datenbank errechnen lässt (21). Bereits 2016 wurde dafür die weltweit größte maschinenlesbare toxikologische Datenbank entwickelt. Diese enthält Informationen über Strukturen, Eigenschaften und möglichen Wirkungen von 10.000 chemischen Verbindungen, die auf 800.000 toxikologischen Tests, allerdings überwiegend aus Tierversuchsstudien, basieren.
Jetzt wurde diese Datenbank durch Algorithmen des maschinellen Lernens erweitert, um die Daten besser lesen zu können und eine „Karte“ bekannter chemischer Strukturen und der damit verbundenen giftigen Eigenschaften zu erstellen. Auch Vergleiche mit Chemikalien ähnlicher Struktur mit bekannter Wirkung werden herangezogen. Damit ist das Computerprogramm innerhalb kürzester Zeit in der Lage für noch nicht getestete Substanzen sowohl strukturell verwandte Chemikalien zu finden als auch eine Vorhersage über mögliche toxische Effekte auf Haut und Schleimhäute oder DNA-Schäden zu machen.
Neben der Fähigkeit dieses neuartigen Systems zuverlässig gesundheitsschädliche Wirkungen von Substanzen vorherzusagen – sofern menschliche Daten zugrunde gelegt werden -, ist die computergestützte Methode in der Anwendung viel günstiger und schneller als der Tierversuch. Mehr dazu >>
Bildgebende Verfahren
Bildgebende Verfahren sind ein wichtiger Baustein zur Erforschung menschlicher Erkrankungen. Untersuchungen mittels Magnetresonanztomographie (MRT) und Computertomographie (CT) beispielsweise liefern wichtige Erkenntnisse in der Hirnforschung, so etwa im Bereich der Epilepsie, neurodegenerativer Erkrankungen oder auch zur Diagnose von Hirntumoren.
Tierversuchsfreie Lehrmethoden für Studium und Ausbildung
Studierende der Biologie, Human- und Tiermedizin müssen an vielen deutschen Hochschulen Tierversuche oder Versuche an getöteten Tieren durchführen. Obwohl das weder ethisch, noch didaktisch sinnvoll ist, sind tierverbrauchende Übungen an vielen Universitäten fester Bestandteil in der studentischen Ausbildung.
Viel sinnvoller lassen sich mit interaktiven Computerprogrammen zahlreiche Praktikumsübungen und sogar Sektionen virtuell am Bildschirm nachvollziehen. Die Physiologie kann mit harmlosen Selbstversuchen am eigenen Körper erfahren werden. Mit myographischen Verfahren lassen sich beispielsweise, anstelle eines Froschmuskels, Nerven- und Muskelströme am Daumen eines Studenten bestimmen. Operationsmodelle aus Kunststoff eignen sich zur Übung chirurgischer Fingerfertigkeiten. Auch für das Erlernen der Anatomie der Tiere ist es absolut nicht notwendig extra Tiere zu töten. Aus medizinischen Gründen eingeschläferte oder tot aufgefundene Tiere können zu diesem Zweck verwendet werden. Wenn solche Tiere plastiniert, d.h. in einen plastikartigen Zustand überführt werden, sind sie zudem unbegrenzt haltbar.
Ein angehender Arzt lernt das Operieren zunächst durch Übungen an menschlichen Leichen und ein Tierarzt an toten, auf natürliche Weise gestorbenen oder aus medizinischer Indikation eingeschläferten Tieren. Im nächsten Schritt erfolgt das Assistieren bei einem erfahrenen Chirurgen, bis man schließlich in der Lage ist, selbst Operationen - zunächst unter Aufsicht - am Patienten vorzunehmen. Mehr zu Tierversuchen im Studium >>
Simulatoren und Virtual Reality
Für die Tiermedizinerausbildung gibt es ähnliche Dummies, z.B. Hündin Alberta der amerikanischen Firma SynDaver. Angehende Tiermediziner können an ihr alle nur denkbaren Eingriffe üben, von der Intubation über Kastration bis zur Tumorentfernung und Knochenoperation.
Die sogenannte Virtual Reality für Chirurgen funktioniert wie ein Flugsimulator in der Pilotenausbildung. Es handelt sich um eine Echtzeit-Simulation mit Videoaufnahmen aus echten OPs und haptischer Wahrnehmung, d.h. der Chirurg fühlt, wenn er mit den Instrumenten auf Gewebe trifft, es schneidet, mit der Pinzette zieht oder schiebt. Das Simulationsprogramm rechnet das Tastgefühl um und präsentiert auf dem Bildschirm entsprechende Bilder aus einer riesigen Videodatenbank. Mehr dazu >>
Unschlagbare Vorteile der tierversuchsfreien Methoden
Wissenschaftlich gut ausgearbeitete In-vitro-Systeme haben gegenüber Tierversuchen eine Reihe von unschlagbaren Vorteilen.
- Zuverlässigkeit
Modelle, die auf menschlichen Zellen oder Daten basieren, bringen gut reproduzierbare und eindeutige Ergebnisse, was im Tierversuch aufgrund u.a. physiologischer und anatomischer Unterscheide zwischen Mensch und Tier nicht möglich ist. - Empfindlichkeit
In-vitro-Systeme reagieren zum Teil wesentlich empfindlicher auf toxische Einflüsse als das lebende Tier. - Kosten
In-vitro-Systemen sind, wenn sie einmal etabliert sind, deutlich billiger als Tierversuche. - Dauer
Studien mit In-vitro-Systemen bringen Ergebnisse im Verlauf von Stunden, während tierexperimentelle Studien Wochen, Monate oder gar Jahre dauern können. - Großer Durchsatz an Testsubstanzen
Mit In-vitro-Systemen lässt sich z.B. bei toxikologischen Studien eine große Anzahl von Pharmaka oder Chemikalien parallel untersuchen, während mit tierexperimentellen Systemen die Möglichkeiten zahlenmäßig begrenzt sind.
Fazit
Tierversuchsfreie Methoden sind weit mehr als eine bloße „Alternative“ zum Tierversuch. Die enorme Bandbreite an humanbasierten, tierversuchsfreien Forschungsmethoden ermöglicht es, zuverlässige Erkenntnisse zu gewinnen. Damit wird nicht nur Tieren ein grausamer und überdies unnötiger Tod im Labor erspart, sondern für uns Menschen endlich ein zukunftsfähiger Weg in der biomedizinischen Forschung eingeschlagen. Der vollständige Ausstieg aus dem System Tierversuch ist dringend notwendig, um die Bahn frei zu machen für solch durchdachte, tierversuchsfreie Methoden, um den medizinischen Fortschritt nicht weiter zu blockieren.
15. Februar 2021
Dipl. Biol. Silke Strittmatter, Dr. med. vet. Corina Gericke
Weitere Infos
NAT-Database - die Datenbank zu tierversuchsfreien Forschungsmethoden >>
Flyer „Forschung ohne Tierleid“ - Im Shop bestellen >>
oder als PDF kostenlos herunterladen >>
Broschüre „Woran soll man denn sonst testen - Moderne Forschungsmethoden ohne Tierversuche“ - Im Shop bestellen >>
oder als PDF kostenlos herunterladen >>
Quellen
- Sicherer als Tierversuche? Informationsdienst Wissenschaft, 20.08.2008
- Nervennetz auf dem Biochip statt Tierversuche, du und das tier, 2/2010, S. 18
- Lunge auf dem Chip, Welt der Physik, 25.06.2010
- Benam KH, Novak R, Nawroth J, et al.: Matched-comparative modeling of normal and diseased human airway responses using a microengineered breathing lung chip. Cell Systems 2016; 3(5): 456-466.e4
- Hassell BA, Goyal G, Lee E, et al.: Human organ chip models recapitulate orthotopic lung cancer growth, therapeutic responses, and tumor dormancy in vitro. Cell Rep. 2017; 21(2): 508-516
- Fachhochschule in Jena entwickelt „das Labor“ auf dem Chip, Thüringer Allgemeine, 21.07.2010
- Versuchskaninchen aus Silizium, Technology Review, Juli 2004, S. 45-48
- Organ-Chips sollen Tierversuche ersetzen. Spektrum.de, 03.08.2015
- Van den Brink FTG, Wigger T, Ma L, et al.: Oxidation and adduct formation of xenobiotics in a microfluidic electrochemical cell with boron doped diamond electrodes and an integrated passive gradient rotation mixer. Lab Chip 2016; 16(20): 3990-4001
- Kim S, LesherPerez SC, Kim BC, et al.: Pharmacokinetic profile that reduces nephrotoxicity of gentamicin in a perfused kidney-on-a-chip. Biofabrication 2016; 8(1): 015021
- Günter A. et al.: A microfluidic platform for probing small artery structure and function. Lab Chip 2010; 10(18): 2341-2349
- Wyss Press release: Harvard's Wyss Institute creates living human gut-on-a-chip, 27.03.2012
- Zietek T et al.: Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports 2015; 5: 16831
- Ortega-Prieto AM, Skelton JK, Wai SN, et al.: 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nat Commun. 2018; 9(1): 682. doi: 10.1038/s41467-018-02969-8
- Blundell C, Tess ER, Schanzer AS, et al.: A microphysiological model of the human placental barrier. Lab Chip 2016: 16; 3065-3073. doi: 10.1039/c6lc00259e
- Nesmith AP, Wagner MA, Pasqualini FS, et al.: A human in vitro model of Duchenne muscular dystrophy muscle formation and contractility. J Cell Biol. 2016; 215(1): 47-56
- Lind JU, Busbee TA, Valentine AD, et al.: Instrumented cardiac microphysiological devices via multimaterial three-dimensional printing. Nat Mater. 2017; 3: 303-308
- Kwon D: Organs on chips. The Scientist, 28.08.2017
- Hamilton J: Minibrains could help drug discovery for Zika and for Alzheimer’s. NRP24, 13.11.2016
- 1964 Surgeon General‘s Report on Smoking and Health, National Center for Chronic Disease Prevention and Health Promotion
- Langley G: A regulatory Smokescreen. BUAV/ECEAE (Hrsg.) 2004, S. 9-10
- Johns Hopkins Bloomberg School of Public Health: Database analysis more reliable than animal testing for toxic chemicals. News Release, 11.07.2018


