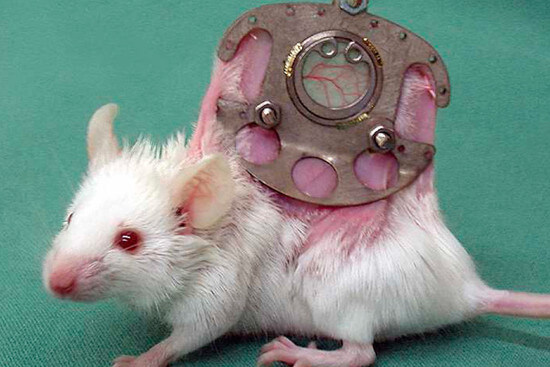
Rückenhautkammer - Eine schwere Last zu tragen
Manchmal sagt ein Bild mehr als tausend Worte – ebenso verhält es sich beim Anblick von Mäusen, denen zu Versuchszwecken eine sogenannte Rückenhautkammer implantiert wurde. Auch wenn wir bei unserer Kritik an Tierversuchen vorwiegend die wissenschaftliche Bedeutung betonen, fällt es hierbei schwer, ethische Bedenken außenvorzulassen. In Zeiten, in denen man menschliche Blutgefäße auf einem Chip züchten kann, ist es nicht nachvollziehbar, dass solche Versuche noch durchgeführt werden dürfen.
Zweifelsohne ist es wichtig, das menschliche Blutgefäßsystem und damit zusammenhängende biochemische Prozesse zu erforschen, denn sie spielen eine entscheidende Rolle bei diversen Erkrankungen wie z.B. Schlaganfall oder Diabetes. Entscheidend ist hierbei jedoch, dass eine Methode eingesetzt wird, die auch zuverlässige Ergebnisse liefert, die für den Menschen relevant sind und die ethisch unbedenklich ist. Bei der sogenannten Rückenhautkammer handelt es sich um eine tierexperimentell basierte Methode, deren Aussagekraft für menschliche Erkrankungen mehr als fragwürdig ist.
Was ist die Rückenhautkammer?
Rückenhautkammern werden seit etwa 1943 in Tierversuchen verwendet, um Veränderungen in der Blutgefäßbildung (Vaskularisierung) über Tage oder Wochen hinweg in vivo, also im lebenden Tier, zu beobachten (1). Sie werden bei Nagern eingesetzt, meist bei Mäusen, aber auch bei Ratten und Hamstern (2). Das Tier wird betäubt und die Kammer chirurgisch implantiert. Dabei wird die Rückenhaut extrem gespannt und wie bei einem Sandwich zwischen 2 Metallrahmen fixiert, die fest zusammengeschraubt werden – hierzu werden Löcher in die Haut der Maus geschnitten. In der Mitte der Metallrahmen befindet sich ein durchsichtiges Beobachtungsfenster, durch das man die Blutgefäße durch die radikal gespannte Haut beobachten kann. Im Bereich des Beobachtungfensters wird dem Tier aus einer Hautseite ein Loch inklusive der Muskelschicht herausgestanzt. Die Kammer wird mit Flüssigkeit gefüllt. Nach diesem schweren Eingriff müssen die Tiere mehrere Tage lang Schmerzmittel erhalten.
Rückenhautkammern für Mäuse wiegen 2-3 Gramm, also über ein Zehntel des durchschnittlichen Körpergewichtes einer Maus, und sind ca. 40 mm mal 20 mm groß (2,3). Vergleichbar würde ein 70 kg schwerer Mensch ein ca. 7-9 kg schweres und 70x35 cm (entspricht etwa einem Standardkopfkissen) großes Metallkonstrukt tage- oder wochenlang ununterbrochen auf dem Rücken tragen.
Die Kammer verbleibt mehrere Tage oder Wochen lang am lebenden und wachen Tier. Um die Blutgefäße in der Kammer mikroskopisch zu beobachten, wird das Tier sediert und häufig noch eine fluoreszierende Flüssigkeit in die Schwanzvene gespritzt. Komplikationen sind bei diesem Verfahren nicht selten. Eine Studie des Universitätsklinikums Leipzig beschreibt, dass es 1-2 Tage nach der operativen Anbringung der Kammer zu einer vermehrten Blutansammlung in dem Bereich kommt und dass 8 % der Tiere danach an Infektionen, Ödemen oder Durchblutungsstörungen leiden (1).
Welche Versuche werden mit Rückenhautkammern durchgeführt?
Unseren Recherchen zufolge werden Tierversuche mit Rückenhautkammern in Deutschland aktuell mindestens noch an der Universität Bonn (4), am Universitätsklinikum Leipzig (1), der Ruhr-Universität Bochum (5), der Technischen Universität München (6) und besonders intensiv an der Universität des Saarlandes (1,7–10) durchgeführt. In dieser Arbeit wird das „Leipziger Kammermodell“ etabliert, dessen Vorteil laut den Forschern die geringere Größe (23 x 31 mm) und das geringere Gewicht (2,3 g) gegenüber anderen Rückenkammermodellen sei, wodurch „eine deutliche Minderung des Leides der Versuchstiere“ erreicht würde. Derartige Arbeiten werden absurderweise als Beitrag zum Tierschutz im Rahmen des 3R-Konzepts dargestellt und nicht selten auch noch mit Forschungsgeldern gefördert, die eigentlich dem Tierschutz und der Entwicklung tierversuchsfreier Forschungsmethoden dienen sollten. Das ist einer der Gründe, warum wir dieses Prinzip ablehnen. Die 3R stehen für Replace (Ersetzen), Reduce (Reduzieren) und Refine (Verbessern). Das 3R-Konzept ist seit 10 Jahren in der EU-Tierversuchsrichtlinie verankert und soll im Grunde dazu dienen, Tierversuche zu reduzieren und tierversuchsfreie Forschung zu fördern. Allerdings zeigen die Versuchstierzahlen in Europa klar und deutlich, dass das Konzept sein Ziel verfehlt hat, denn in den letzten 10 Jahren sind die Zahlen keinesfalls gesunken. Deswegen fordern wir eine wirksame politische Strategie, um Tierversuche abzuschaffen und konsequent auf eine tierversuchsfreie Forschung umzusteigen.
Auch in der Krebsforschung werden Rückenhautkammern eingesetzt. So untersuchen Forscher der Universität des Saarlandes an Mäusen den Einfluss des potenziellen Krebsmedikaments Geraniol auf das Tumorwachstum bzw. die Blutgefäßentwicklung (7). 48 Stunden nach Implantation der Kammern werden diese wieder geöffnet und im Labor vorgezüchtete Mikrotumore eingesetzt. Einer Gruppe an Mäusen wird danach 2 Wochen lang täglich Geraniol per Schlundsonde verabreicht, die Tiere der Kontrollgruppe erhalten Öl als Kontrolle. Im Anschluss an die Versuche werden alle Tiere getötet und das Gewebe der Rückenhautkammer hinsichtlich Tumorwachstum und Blutgefäßentwicklung untersucht.
Absurd und unnötig
Weitere Anwendungsgebiete für Rückenhautkammern sind z.B. Entzündungsforschung, Biomaterial-Forschung, Dermatologie oder auch die Untersuchung von Wundheilungsprozessen. In einer weiteren Studie der Universität des Saarlandes wird 72 Stunden nach Anbringung der Rückenhautkammer das darin befindliche Gewebe der Mäuse mit einer Substanz behandelt, die starke Entzündungsreaktionen verursacht (10). Um die Wirkung des Schmerzmittels Diclofenac (Handelsname Voltaren) zu testen, wird bei einem Teil der Mäuse ein wirkstoffhaltiges Gel in die Kammer eingebracht. 1 Stunde vor der Behandlung sowie 1, 4 und 24 Stunden danach werden die Tiere jeweils kurz betäubt und ihnen wird ein fluoreszierendes Mittel mit einer Nadel in das Venengeflecht hinter dem Auge gespritzt. Sobald die Tiere wieder wach sind, werden sie in ein enges röhrenförmiges Gefäß gesteckt. Die Entzündungsvorgänge im Gewebe in der Rückenhautkammer werden nun an den fixierten Mäusen mikroskopisch untersucht. Nach den letzten Aufnahmen werden alle 14 Tiere getötet und das Gewebe in den Rückenhautkammern analysiert. In einem zweiten Experiment wird bei weiteren 14 Mäusen in der Rückenhautkammer die Bildung von Thromben (Blutgefäß-Verschlüssen) hervorgerufen, indem das Gewebe mit Licht bestimmter Wellenlänge bestrahlt wird. Erneut wird bei einigen Tieren das Diclofenac-haltige Gel auf das Gewebe appliziert. Die Wirkung wird wie oben beschrieben mikroskopisch untersucht und die Mäuse werden anschließend getötet. In dieser Publikation bezeichnen die Autoren die Rückenhautkammer als ideales „Modell“, um oberflächliche Entzündungsreaktionen zu untersuchen. Gleichzeitig schreiben sie aber, dass sich die Haut von Mäusen bekanntermaßen stark von der menschlichen Haut unterscheidet. Demnach ist die Sinnhaftigkeit der vorliegenden Arbeit mehr als fraglich und ein Nutzen für den Menschen nicht ersichtlich. Diclofenac wird zudem seit langem bei Menschen angewandt. Die entzündungshemmende Wirkung ist am Menschen untersucht, ebenso ist bekannt, dass Diclofenac die Blutgerinnung senkt und das Risiko für Thrombosen erhöht.
Den Absurditäten sind keine Grenzen gesetzt. An der Ruhr-Universität Bochum wurde eine sogenannte Taucherbox entwickelt, um den Effekt von Schockwellen auf die Wundheilung zu untersuchen (5). Beim Anbringen der Rückenhautkammern wird im Bereich des Beobachtungsfensters im Hautmuskel zusätzlich eine Wunde verursacht, indem der Maus ein Stück des Gewebes ausgestanzt wird. 24 Stunden nach dem schweren operativen Eingriff kommen die Mäuse unter Narkose in die „Taucherbox“. Die betäubte Maus wird in eine enge Plastikröhre gesteckt, aus der die Rückenhautkammer herausragt. In dieser Röhre wird die Maus mit dem Rücken nach unten an der Taucherbox befestigt, so dass die Rückenhautkammer in das Wasser eingetaucht ist. Dann werden durch eine Öffnung in der Taucherbox Schockwellen eingeleitet, die auf die Rückenhautkammer treffen. Die Prozedur dauert über eine halbe Stunde. Das Gewebe in der Rückenhautkammer wird alle paar Tage fotografiert und mikroskopiert. Bei 13% der Mäuse kommt es im Verlauf der Versuche zu diversen Komplikationen, u.a. treten Ödeme und Entzündungen auf.
Es gibt bessere Methoden
Besonders tragisch ist es, dass Tierversuche mit Rückenhautkammern immer noch eingesetzt werden, obwohl bereits heute bessere Verfahren verfügbar sind. Humane Blutgefäße lassen sich schon lange aus menschlichen Stammzellen in vitro züchten und können in Multi-Organ-Chip-Systeme integriert und mit anderen humanen Mini-Organen kombiniert werden, um systemische Vorgänge zu simulieren. Beispielsweise haben Forscher aus Barcelona, Vancouver und Stockholm humane Blutgefäße und Nierenorganoide aus menschlichen Stammzellen gezüchtet, die effizient mit dem SARS-CoV-2 Virus („Coronavirus“) infiziert wurden (11). Anschließend wurden sie mit dem Wirkstoff ACE2 (Angiotensin Converting Enzyme 2) behandelt, der an das Virus andocken und es somit unschädlich machen kann. Es zeigte sich, dass die Infektion mit humanem ACE2 eingedämmt werden konnte, während die in der Maus vorkommende ACE2-Variante, die zum Vergleich gegeben wurde, keine Reduktion der Viruslast bewirkte. Hieran zeigt sich einmal mehr, wie wichtig es ist, dass für die Erforschung menschlicher Erkrankungen vollständig humanbasierte Systeme eingesetzt werden.
Forscher aus der Schweiz und aus den Niederlanden haben ein relevantes mikrofluidisches 3D-Gefäßsystem auf einem Chip etabliert, mit dem Abläufe in den Zellen untersucht werden können (12). Das Modell ist geeignet für Anwendungen in der Gefäßkrankheitsforschung und der Wirkstoffforschung bzw. Toxikologie.
Auch für die Dermatologie und die Untersuchung von Substanzen, die auf der Haut appliziert werden, wie beispielsweise das Diclofenac-Gel, braucht es keine Tierversuche. Es gibt zahlreiche exzellent etablierte und kommerziell verfügbare Modelle, die z.T. sogar validiert und für die Sicherheitstestung von Chemikalien gesetzlich akzeptiert sind (13,12). Die Hautmodelle bestehen aus diversen humanen Zellen und enthalten verschiedene Hautschichten, z.T. sind sie auch mit Blutgefäßen durchzogen (15). Sie sind u.a. ausgezeichnet geeignet für diverse dermatologische Bereiche, u.a. Untersuchungen von Wundheilungsprozessen und Entzündungsforschung.
Wie in vielen anderen Bereichen ist es auch bei Tierversuchen mit Rückenhautkammern nicht nachvollziehbar, dass in Anbetracht der Vielfalt gut etablierter tierversuchsfreier Forschungsmodelle, die uns heutzutage zur Verfügung stehen, immer noch solche Experimente durchgeführt werden. Im Gegensatz zu den modernen humanbasierten Verfahren liefern derartige Tierexperimente weder eine zuverlässige Übertragbarkeit auf den Menschen, noch stellen sie einen nennenswerten Nutzen zur medizinischen Entwicklung dar. Moderne Medizin braucht moderne Forschungsmodelle – und die sind humanbasiert und tierversuchsfrei.
29.09.2020
Dr. rer. nat. Tamara Zietek
Quellen
- Schreiter J et al. Dorsal skinfold chamber models in mice. GMS Interdiscip Plast Reconstr Surg 2017; 6
- Laschke MW et al. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. Eur Cell Mater. 2011; 22:147-64
- Schmauss D et al. Long-term pre- and postconditioning with low doses of erythropoietin protects critically perfused musculocutaneous tissue from necrosis. J Plast Reconstr Aesthet Surg. 2019; 72(4):590–9
- Rieck S et al. Local anti-angiogenic therapy by magnet-assisted downregulation of SHP2 phosphatase. J Control Release. 2019; 305:155–64
- Sorg H et al. A novel technique for the standardized application of shock waves in experimental research: The diver box. Ultrasound Med Biol. 2018; 44(7):1563–8
- Schmauss D et al. Long-term pre- and postconditioning with low doses of erythropoietin protects critically perfused musculocutaneous tissue from necrosis. Journal of Controlled Release 2019; 305:155–164
- Wittig C et al. Geraniol Suppresses Angiogenesis by Downregulating Vascular Endothelial Growth Factor (VEGF)/VEGFR-2 Signaling. PLoS One. 2015; 10(7):e0131946
- Karschnia P et al. Erythropoietin promotes network formation of transplanted adipose tissue-derived microvascular fragments. Eur Cell Mater. 2018; 35:268–80
- Laschke MW et al. Insulin-like growth factor 1 stimulates the angiogenic activity of adipose tissue-derived microvascular fragments. J Tissue Eng. 2019; 10:2041731419879837
- Dahmke IN et al. The dorsal skinfold chamber: A valuable model for the in vivo evaluation of topical formulations. Exp Dermatol. 2019; 28(8):940–7
- Monteil V et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 2020; 181(4):905-913
- Poussin C et al. 3D human microvessel-on-a-chip model for studying monocyte-to-endothelium adhesion under flow – application in systems toxicology. ALTEX. 2020; 37(1):47–63
- EpiDerm in vitro 3D Tissue. MatTek Life Sciences. Aufgerufen am 29.09.2020 unter https://www.mattek.com/products/epiderm/
- Eskes C et al. The ECVAM international validation study on in vitro tests for acute skin irritation: Selection of test chemicals. Altern Lab Anim. 2007; 35(6):559-601
- Groeber F et al. A first vascularized skin equivalent as an alternative to animal experimentation. ALTEX. 2016; 33(4):415–22