Antikörper aus Phagen
Jeder Arzt und jeder Biologe hat ständig damit zu tun und alle wissen auch wo sie herkommen. Die Rede ist von Antikörpern für die Diagnose, die Immunologie, die Therapie und auch für die Grundlagenforschung. Um Antikörper herzustellen wird zuerst ein Tier mit den gewünschten Proteinen (Antigen) immunisiert. Das Prinzip der Immunisierung ist das Gleiche wie eine Impfung. Hierbei wird das Tier mit dem Antigen, gegen das es Antikörper bilden soll, geimpft.Es gibt sogenannte monoklonale und polyklonale Antikörper. Polyklonale Antikörper werden meistens aus dem Blut immunisierter Kaninchen, Eseln oder Ziegen und auch aus Hühnereiern gewonnen. Monoklonale Antikörper werden bis heute fast immer aus Milzzellen von Mäusen gemacht. Da diese Antikörper aus normalen Mäusen für viele Zwecke der Humanmedizin unbrauchbar sind, werden dafür zuerst genmanipulierte Mäuse hergestellt. Diese müssen im Normalfall über 10 Generationen inngezüchtet werden, bis man dann einige Mäuse immunisiert und für ihre Milz schlachtet. Für einen einzigen monoklonalen Antikörper aus genmanipulierten Mäusen benötigt man demnach etwa 100 Mäuse. Man geht heute davon aus, dass allein der menschliche Körper, grob geschätzt, mindestens 100.000 verschiedene Proteine produziert. Will man also nur alleine für die menschlichen Proteine monoklonale Antikörper herstellen, endet man im totalen Gemetzel. Keiner bestreitet, dass wir die Antikörper brauchen. Aber sind Mäuse wirklich die Lösung dafür?Nein! Wir sind heute schon einiges weiter und man kann sehr einfach und ohne Tierquälerei viel bessere und sinnvollere Antikörper herstellen. Die Lösung heißt auf Englisch “Phage Display for the Generation of Antibodies” – zu Deutsch in etwa “Die Suche in Phagen Genbanken nach passenden Antikörpern”.
Phagen
Phagen oder Bakteriophagen sind Viren von Bakterien. Sie befallen also Bakterienzellen und nutzen die Zelle, um sich zu vermehren. Jeder Bakterienstamm hat seine eigenen Phagen. Es gibt also eine Unmenge an verschiedenen Phagen, da es ja auch Unmengen an verschiedenen Bakterien gibt.
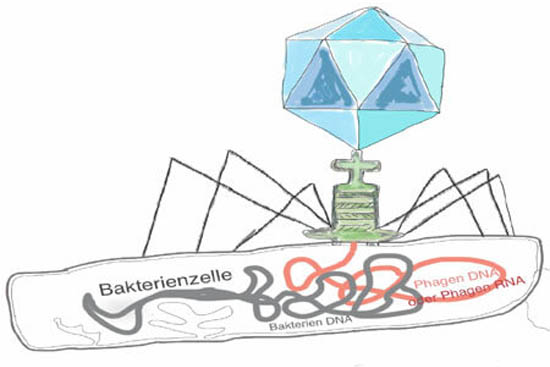
Ein Phage injiziert sein Genom aus DNA oder RNA in eine Bakterienzelle. (Im Verhältnis ist die Bakterienzelle um einiges grösser als dargestellt)Für Genbanken in Phagen haben sich sogenannte M13 Phagen bewährt. Dies hat damit zu tun, dass M13 Escherichia coli befällt, das sogenannte Haustier von Biologen, und sich relativ einfach im Reagenzglas halten lässt.
Gene
Der M13 Phage besteht, wie viele Viren, aus einem DNA Strang, der in einem Hüllproteinmantel verpackt ist. In diesen Mantel kann M13 zusätzlich DNA Stücke mit einpacken. Das was er mit einpackt, nennt man “Phagemid”. Diese Phagemide brauchen eine bestimmte Erkennungssequenz, aber zusätzlich kann man mit einpacken, was man möchte. Zum Einpacken benutzt man Hilfsphagen, die dies zuverlässig mit vielen verschiedenen Genen oder Genabschnitten machen können. So gibt es heute Bausätze zu kaufen, mit denen man sich das alles selber basteln kann. Aber es gibt auch Firmen die einem die gewünschten Gene einbauen und dann die fertigen Phagen verkaufen.

M13 Phage mit Phagemid und Antikörper am Mantel
Antikörper Banken
Antikörper Banken, aus dem Englischen “library”, beinhalten viele verschiedene Genabschnitte für Antikörper. Man produziert eine große Mischung aus Phagen, bei denen jede Phage eine andere Sequenz für Antikörper mit sich trägt. Es gibt heute schon eine Menge fertiger Banken und man muss sich nur ein paar Mikroliter davon besorgen und kann sie dann in Bakterien beliebig vervielfältigen. So gibt es schon seit 1999 eine Phagen Bank mit menschlichen Antikörpern und es werden ständig mehr.
Panning
Als Panning wird die Suche nach dem Phagen mit dem gewünschten Genfragment bezeichnet. Im Falle von Antikörpern ist dies sehr einfach. Wie oben erklärt, hat der Phage einen Proteinmantel an. Mit den Hilfsphagen und dem Phagemid wird auf den Mantel der Antikörper aufgeknüpft. Falls der Antikörper sein passendes Gegenstück findet, klebt der ganze Phage daran fest. So kann man dann alle Phagen, die eine nicht erwünschte Sequenz tragen, abwaschen und nur den klebenden Phagen weiter vermehren. Nach mehreren Runden hat man nur noch Phagen mit dem selben Antikörper übrig. Dann muss man nur noch lesen, was auf dem Phagemid dieser Phagen steht. Diese Sequenz kann man dann überall, wo gewünscht, einbauen.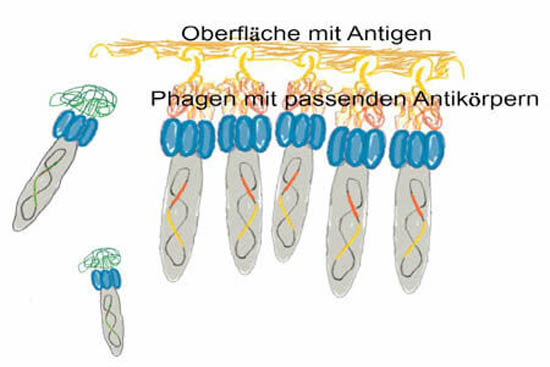
Panning ist das Suchen in der Phagen Bank nach Phagen mit passendem Antikörper für das gewünschte Antigen.
Diskussion
Wie man sieht, gibt es sehr effektive und automatisierbare Methoden jenseits der Benutzung von Mäusen. Auch die Industrie hat dies schon lange erkannt und es haben sich Unternehmen wie CAT, Abbott, Morphosys und Dyax darauf spezialisiert.Natürlich werden einige Wissenschaftler auch Nachteile der Phagen Technik sehen, wie, dass Bakterien nur begrenzt die Proteine richtig falten können. Hier sei deshalb darauf hingewiesen, dass es durchaus für jeden Bedarf eine Reihe anderer Methoden gibt, die alle möglichen Bedürfnisse der Forscher abdecken. Hier sind die englischen Bezeichnungen der verschiedenen Methoden aufgelistet:
- Phage Display (oben erklärt)
- Yeast Display
- Bacterial Display
- mRNA Display
- Ribosome Display
Es gibt heute keinen Grund mehr Tiere für die Antikörperproduktion zu benutzen. Tiere werden nicht “verbraucht”, weil die Wissenschaftler müssen, sondern weil die Wissenschaftler zu bequem oder desinteressiert sind, neue Technologien zu benutzen und für ihre Zwecke weiter zu entwickeln.Vielen Dank an Frau Dr. Corina Gericke für ihre hilfreichen Kommentare.
7.1.2014
Dr. Hannah Miriam Jaag, Freie Wissenschaftlerin
Quellen
Phage display for the generation of antibodies for proteome research, diagnostics and therapy. Schirrmann T, Meyer T, Schütte M, Frenzel A, Hust M. Molecules.10; 16(1):412-26. (2011)A large non-immunized human Fab fragment phage library that permits rapid isolation and kinetic analysis of high affinity antibodies. de Haard HJ, van Neer N, Reurs A, Hufton SE, Roovers RC, Henderikx P, de Bruïne AP, Arends JW, Hoogenboom HR.J Biol Chem. (1999)
